题目内容
4.某种物质可能由甲酸、乙酸、甲醇和甲酸乙酯四种物质中的一种或几种组成,进行鉴定时实验记录如下:①有银镜反应②加入新制的Cu(OH)2悬浊液不溶解③滴入几滴稀NaOH溶液和酚酞试液后加热,溶液呈红色,加热后溶液变无色.下列判断正确的是( )| A. | 一定有甲酸乙酯,可能有甲醇 | B. | 四种物质都有 | ||
| C. | 有甲酸乙酯和甲酸 | D. | 有甲醇和甲酸 |
分析 ①有银镜反应;说明分子结构中含有醛基;
②加入新制氢氧化铜悬浊液,未发现变澄清,沉淀不溶解,说明不含羧酸;
③与含酚酞的氢氧化钠溶液共热,红色逐渐消失,说明和氢氧化钠反应.
解答 解:①有银镜反应,说明分子结构中含有醛基,含甲酸或甲酸乙酯或都有;
②加入新制氢氧化铜悬浊液,未发现变澄清,沉淀不溶解,则说明不含羧酸,则没有甲酸;
③与含酚酞的氢氧化钠溶液共热,红色逐渐消失,说明和氢氧化钠反应,而醇、醛不与NaOH反应,
则一定含有甲酸乙酯,一定不存在甲酸,可能有甲醇,
故选A.
点评 本题考查了有机物的鉴别,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握分子结构中官能团的特征性质是解题关键,熟悉醛、酯的性质即可解答,题目难度中等.

练习册系列答案
 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目
14.下列说法错误的是( )
| A. | 氨是极性分子,其在水中的溶解度很大 | |
| B. | DNA中的碱基互补配对是通过氢键来实现的 | |
| C. | 气体单质中,一定有σ键,可能有π键 | |
| D. | 元素“氦、铷、铯”等是用光谱分析方法发现的 |
12.反应A(g)+3B(g)?2C(g)+2D(g),在四种不同情况下用不同物质表示的反应速率分别如下,其中反应速率最大的是( )
| A. | v(A)=0.15mol/(L•min) | B. | v(B)=0.04mol/(L•s) | ||
| C. | v(C)=0.03mol/(L•s) | D. | v(D)=0.4mol/(L•min) |
19.以下实验不能获得成功的是( )
| A. | 将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色 | |
| B. | 提取溶解在水中的少量碘时加入CCl4,分液,取出有机层再分离 | |
| C. | 用适量苯和液溴混合制溴苯时,只需加铁屑,不必加热 | |
| D. | 除去溴苯中的少量Br2时加入KI溶液,充分反应后,弃去水溶液 |
20.据外电报道,中国自行研制的第四代隐身战机也已经进入了试飞阶段,由于我国航空工业基础薄弱,如此神速的研制速度让西方先进国家感到非常吃惊.高科技飞机的生产离不开先进材料,你认为下列材料不宜在飞机上使用的是( )
| A. | 机身隔框一般采用超硬铝,承受较大载荷的加强框采用高强度结构钢或钛合金 | |
| B. | 航空发动机对材料的要求非常高,所以其气缸必须使用纯度相当高的金属材料 | |
| C. | 很多飞机的机载雷达装在机身头部,一般采用玻璃纤维增强塑料做成的头锥将机身头部罩住以便能透过电磁波 | |
| D. | 采用特殊的新型复合材料作为表面涂层,使其几乎不反射雷达所发出的电磁波,雷达就检测不到 |
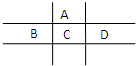 有A、B、C、D、E五种短周期元素,且相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的氢氧化物是两性氢氧化物,E的阳离子与A的阴离子核外电子层结构相同.
有A、B、C、D、E五种短周期元素,且相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的氢氧化物是两性氢氧化物,E的阳离子与A的阴离子核外电子层结构相同. ,分子中所含共价键的类型为极性键、非金属性键.
,分子中所含共价键的类型为极性键、非金属性键.