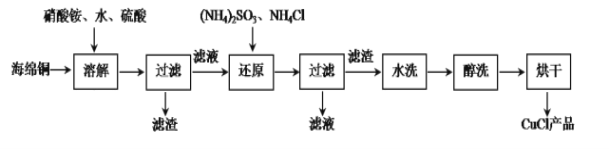
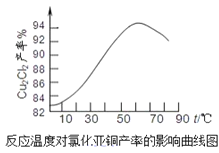
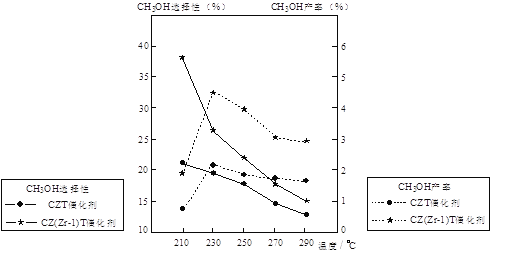
��Ŀ����
����Ŀ���ɽ���߷��Ӳ���P�ĽṹΪ�� ����ͼ��P�ĺϳ�·�ߡ�
����ͼ��P�ĺϳ�·�ߡ�

��֪��![]() +R3OH
+R3OH![]() +R2OH��
+R2OH��
��1��B�Ľṹ��ʽ��_______���Լ�a��_______��
��2���۵Ļ�ѧ����ʽ��______��
��3��G��E��Ϊͬ���칹�壬��������Ҫ���G����______�֡�(�����������칹)�ٺ��к�E(C6H10O3)��ͬ�ĺ��������Ţڷ����к�����Ԫ��״�����ṹ
��4�������з�Ӧ�������ʵ���֮��1��1������Ӧʱ����Ӧ�ݵĻ�ѧ����ʽ��_____��
���𰸡�BrCH2CH2Br NaOHˮ��Һ ![]() 20
20 ![]()
��������
C2H4Ϊ��ϩ���ṹΪCH2=CH2����Br2�����ӳɷ�Ӧ������B��BrCH2CH2Br����������������ˮ��Һ�ɷ���ˮ�ⷴӦ����D�Ҷ�����HOCH2CH2OH����D��![]() ����������Ӧ������E��
����������Ӧ������E��![]() ����
����![]() ��ROH��Ӧ����F��F�ĽṹΪ
��ROH��Ӧ����F��F�ĽṹΪ![]() ��F�������۷�Ӧ����
��F�������۷�Ӧ����![]() ��
��![]() ��
��![]() ��Ӧ����
��Ӧ����![]() ��
��![]() ��
��![]() ��Ӧ���ɸ߷��Ӳ���P���Դ�����
��Ӧ���ɸ߷��Ӳ���P���Դ�����
�ɷ�����֪AΪCH2=CH2��BΪBrCH2CH2Br��DΪHOCH2CH2OH��EΪ![]() ��FΪ
��FΪ![]() ��
��
��1��BΪBrCH2CH2Br��D���Լ�a�����ķ�ӦΪˮ�ⷴӦ������Լ�aΪ�������Ƶ�ˮ��Һ��
��2����Ӧ��ΪHOCH2CH2OH��![]() ������������Ӧ������ʽΪ��
������������Ӧ������ʽΪ��![]() ��
��
��3��EΪ![]() ��G��E��Ϊͬ���칹�壬�Ңٺ��к�E(C6H10O3)��ͬ�ĺ��������ţ�˵��G�к����������ǻ����ڷ����к�����Ԫ��״�����ṹ��˵�������ڻ��ڣ�����
��G��E��Ϊͬ���칹�壬�Ңٺ��к�E(C6H10O3)��ͬ�ĺ��������ţ�˵��G�к����������ǻ����ڷ����к�����Ԫ��״�����ṹ��˵�������ڻ��ڣ����� �ṹ���ɴ˿�֪�ṹ����1��-CH2OH��1��-CH3��1��-OH������Ԫ����������1��-CH2OH����4�ֲ�ͬ�Ľṹ������Ԫ����������1��-CH3��1��-OH������-CH3��-OH�ֱ�������2����ͬ��̼ԭ���ϵĽṹ��12�֣�������ͬһ��̼ԭ���ϵĽṹ��4�֣���˷���������/span>G��4+12+4=20�֣�
�ṹ���ɴ˿�֪�ṹ����1��-CH2OH��1��-CH3��1��-OH������Ԫ����������1��-CH2OH����4�ֲ�ͬ�Ľṹ������Ԫ����������1��-CH3��1��-OH������-CH3��-OH�ֱ�������2����ͬ��̼ԭ���ϵĽṹ��12�֣�������ͬһ��̼ԭ���ϵĽṹ��4�֣���˷���������/span>G��4+12+4=20�֣�
��4�������з�Ӧ�������ʵ���֮��1��1������Ӧʱ����Ӧ�ݵĻ�ѧ����ʽΪ��![]() ��
��

 ����5��2���ϵ�д�
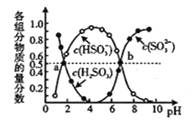
����5��2���ϵ�д�����Ŀ��̼��̼�Ļ������������������е�Ӧ�÷dz��㷺�����ᳫ���������ѳɳ����Ľ��죬����̼����������ֻ��һ�����룬����һ��ֵ���ڴ����µ����ʽ��
(1) ����ȼ�շų��������ȣ�����Ϊ��Դ������������������
��֪����2CH4��g��+3O2��g��=2CO��g��+4H2O��l����H1=-1214kJ/mol
��2CO(g)+O2(g)=2CO2(g) ��H2=-566 kJ/mol
���ʾ����ȼ���ȵ��Ȼ�ѧ����ʽ____________________________________��
(2) ������ʯī�缫����KOH��Һ�У��������ֱ�ͨ��CH4��O2�����ɼ���ȼ�ϵ�ء��为���缫��Ӧʽ�ǣ�_____________________________��
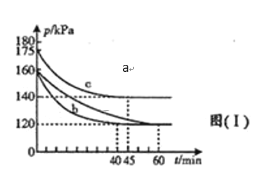
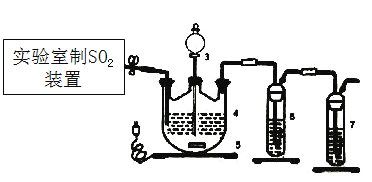
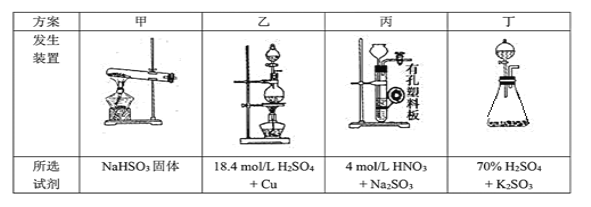
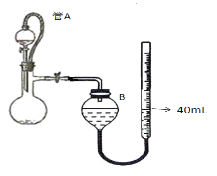
��3��ijͬѧ���ü���ȼ�ϵ�������һ�ֵ�ⷨ��ȡFe(OH)2��ʵ��װ�ã�����ͼ��ʾ����ͨ�����Һ�в��������İ�ɫ�������ҽϳ�ʱ�䲻��ɫ������˵������ȷ����______������ţ�

A����Դ�е�aһ��Ϊ������bһ��Ϊ����
B��������NaCl��Һ��Ϊ���Һ
C��A��B���˶������������缫
D�����������ķ�Ӧ�ǣ�2H++ 2e��= H2��
��4������ͬ����CO��g����H2O��g���ֱ�ͨ�����Ϊ2L�ĺ����ܱ������У����з�Ӧ��
CO��g��+H2O��g��===CO2��g��+H2��g�����õ������������ݣ�
ʵ���� | �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | |
H2O | CO | CO2 | |||
1 | 650 | 2 | 4 | 1.6 | 5 |
2 | 900 | 1 | 2 | 0.4 | 3 |
3 | 900 | 1 | 2 | 0.4 | 1 |
��ʵ��
��ʵ��3��ʵ��2��ȣ��ı������������_________________����һ��������ɣ���