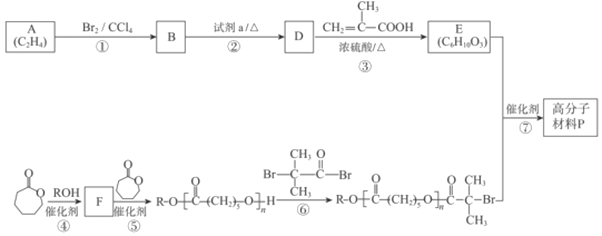
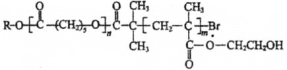��Ŀ����
����Ŀ���Ȼ���ͭ��һ����Ҫ�Ļ�����Ʒ���������л��ϳɴ����������������ϡ������ȹ�ҵ����������H2SO4��HNO3�ʹ�������ˮ��������Ũ����Ͱ�ˮ���ڳ�ʪ��������ˮ����������ɫ�ļ�ʽ�Ȼ�ͭ[Cu2��OH��4-nCln]�����Ż�����ȵĸı�n��֮�ı䡣�Ժ���ͭ����Ҫ�ɷ���Cu������CuO��Ϊԭ�ϣ���������������ֽ⼼������CuCl�Ĺ��չ������£�

��1�������õ��IJ����������ձ�����������________��
��2����ԭ�����з�������Ҫ��Ӧ�����ӷ���ʽ��__________������(NH4)2SO3��������Ҳ�ɵõ�CuCl��д�����ӷ���ʽ___________��
��3��������CuCl����ˮϴ��Ҫ��������ˮ�Ҵ�ϴ�ӣ�����ո��������70�����2h����ȴ�ܷ��װ����ո���ܷ��װ��ԭ���ǣ�______________________________��
��4������PHֵ��С[Cu2��OH��4-nCln]��Cu% ________��(����ĸ)
A. ���� B.���� C. ����ȷ�� D. ��С
��5����ͼ�Ǹ���Ӧ���������������£���Ӧ�¶ȶ�CuCl����Ӱ�졣��ͼ��֪����Һ�¶ȿ�����60��ʱ��CuCl�����ܴﵽ94%�����¶ȸ���65�� ʱ��CuCl���ʻ��½�����������ĽǶȷ�������ԭ�������_____��

��6����̼��Ϊ�缫���CuCl2��ҺҲ�ɵõ�CuCl��д�����ʱ�����Ϸ����ĵ缫��Ӧʽ��______��
���𰸡�©�� 2Cu2++SO32-+2Cl-+ H2O=2CuCl��+SO42-+2H+ Cu2++ 2Cl-+ Fe=2CuCl��+Fe2+ ��ֹCuCl�ڳ�ʪ�Ŀ�����ˮ������ D �¶ȹ��ߣ��ٽ���CuCl��ˮ�⣨���¶ȹ��ߣ��ٽ���CuCl�������������Ӧ�� Cu2++e-+Cl-=CuCl��
��������
������������������Ӿ��������ԣ�����������ͭ(��Ҫ�ɷ���Cu������CuO)��������ͭ�����˺�����Һ�м���������立���������ԭ��Ӧ����CuCl������2Cu2++SO32-+2Cl-+ H2O=2CuCl��+SO42-+2H+����������ϴ��ˮϴ�������Ҵ�ϴ�ӣ���ɵõ��Ȼ���ͭ��
��1������ʱ�õ�������©�����ձ�����������
��2����ԭ����������ͭ��������李��Ȼ�狀�ˮ��Ӧ�����Ȼ���ͭ����������李����ᣬ���ӷ���ʽΪ2Cu2++SO32-+2Cl-+ H2O=2CuCl��+SO42-+2H+������ΪFeʱ��ͭ���������������ӷ�Ӧ�����������Ӻ��Ȼ���ͭ�����ӷ���ʽΪCu2++ 2Cl-+ Fe=2CuCl��+Fe2+��
��3���Ȼ���ͭ�ڳ�ʪ��������ˮ����������ɫ�ļ�ʽ�Ȼ�ͭ����ո���ܷ��װ�ɷ�ֹCuCl�ڳ�ʪ�Ŀ�����ˮ��������
��4������pHֵ��С����Һ��c��H+��������[Cu2��OH��4-nCln]��OH-������С����Cl-��������Ħ������������Cu�İٷֺ�����С����ΪD��
��5���¶ȹ���ʱ��CuCl������е�������Ӧ����ٽ���CuCl��ˮ�⣬����CuCl�����½���
��6�����ʱ�����õ��ӣ���ͭ���ӵõ��ӣ��������ӷ�Ӧ�����Ȼ���ͭ�������缫��ӦʽΪCu2++e-+Cl-=CuCl����

����Ŀ���������ŷŵ���Ⱦ����Ҫ��̼�⻯���һ����̼�͵�������ȡ�
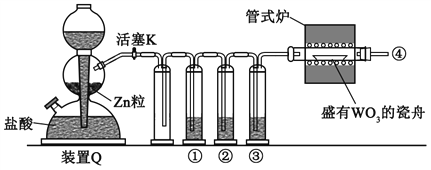
I������ȼ�ͳ��ϰ�װ��Ԫ��ת����������Ч��������β����Ⱦ��
(1)��֪�� C(s)+O2(g) = CO2(g) ��H1 �� 393.5kJ��mol1
2C(s)+O2(g) = 2CO(g) ��H2 �� 221.0 kJ��mol1
N2(g)+O2(g) = 2NO(g) ��H 3 ��+180.5 kJ��mol1
CO��NO����β���ڴ�������������N2���Ȼ�ѧ����ʽ��_________________________��
(2)�о�CO��NO�Ĵ���Ӧ�������崫���������ij�¶��¡�һ��������ܱ������У���ͬʱ��NO��COŨ�����±���
ʱ�䣨s�� | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/��______��4mol��L1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(CO)/��______��3mol��L1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
�� ǰ4 s�ڵ�ƽ����Ӧ���ʦ�(CO) ��______mol��L1��s1��
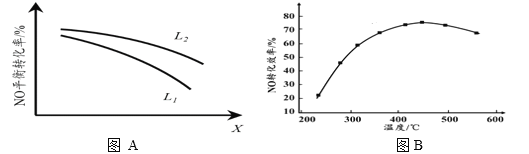
�� L��X�ɷֱ����ѹǿ���¶ȡ���ͼA��ʾLһ��ʱ��NO(g)��ƽ��ת������X�ı仯��ϵ��X��������������______���ж�L1��L2�Ĵ�С��ϵ�����������ɣ�______________________________��
(3)ʵ���ã�v��=k����c2(NO)��c2(CO)��v��=k����c(N2) ��c2(CO2)��k����k��Ϊ���ʳ�����ֻ���¶��йأ���
�ٴﵽƽ��������¶ȣ�k������ı���______���>������<
������2 L���ܱ������г���1 mol CO��1 mol NO����һ���¶��´ﵽƽ��ʱ��CO��ת����Ϊ40%����k���Uk�� =___________��������һλС����
II. �������÷�ӦC(s)+2NO(g) ![]() N2(g)+CO2(g) ��H = 34.0 kJ��mol1���û���̿��NO���������������ܱ������м���������C��һ������NO���岢�ڴ��������·�����Ӧ������ͬʱ����NO��ת�������¶ȵı仯��ͼB��ʾ����ͼ��֪���ת���ʶ�Ӧ�¶�Ϊ450�档����450��ʱ��NO��ת�����Dz��Ƕ�Ӧ�¶��µ�ƽ��ת���ʼ��ж�������________________________��
N2(g)+CO2(g) ��H = 34.0 kJ��mol1���û���̿��NO���������������ܱ������м���������C��һ������NO���岢�ڴ��������·�����Ӧ������ͬʱ����NO��ת�������¶ȵı仯��ͼB��ʾ����ͼ��֪���ת���ʶ�Ӧ�¶�Ϊ450�档����450��ʱ��NO��ת�����Dz��Ƕ�Ӧ�¶��µ�ƽ��ת���ʼ��ж�������________________________��