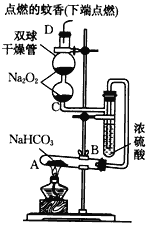
题目内容
【题目】有机物H是一种中枢神经兴奋剂,其合成路线如下图所示。
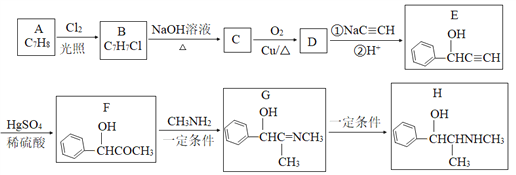
请回答下列题:
(1)A的化学名称为_________,C的结构简式为________。
(2)E中官能团的名称为________。B→C、G→H的反应类型分别为________、________。
(3)D分子中最多有_____个原子共平面。
(4)F→G历经两步反应,第一步反应的化学方程式为______________。
(5)同时满足下列条件的F的同分异构体有_____种(不考虑立体异构)。
①能发生银镜反应;②能与氯化铁溶液反应;③分子中只有1个甲基。
其中核磁共振氢谱有6组峰的结构简式为__________。
(6)参照上述合成路线和信息,以乙烯为原料制备强吸水性树脂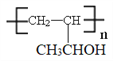 的合成路线流程图(可选择题干中相关试剂,无机试剂任选)_____________________________。
的合成路线流程图(可选择题干中相关试剂,无机试剂任选)_____________________________。
【答案】 甲苯 ![]() 羟基、碳碳三键 取代反应 加成反应 14
羟基、碳碳三键 取代反应 加成反应 14 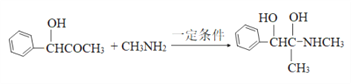 23
23 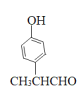
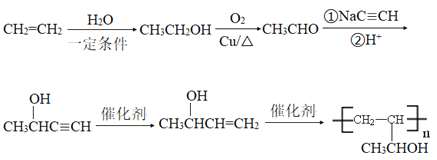
【解析】分析:由题中信息可以推知,A为甲苯,B为![]() ,C为
,C为![]() ,C发生催化氧化生成D,D为苯甲醛,D与发生加成反应后再酸化生成E。据此解答。
,C发生催化氧化生成D,D为苯甲醛,D与发生加成反应后再酸化生成E。据此解答。
详解:(1)根据以上分析可知A的化学名称为甲苯,C的结构简式为![]() 。
。
(2)E中官能团的名称为羟基、碳碳三键。B→C、G→H的反应类型分别为取代反应、加成反应。
(3)由于苯环和醛基均是平面形结构,则苯甲醛分子中最多有14个原子共平面。
(4)F→G历经两步反应,首先是羰基的加成反应生成羟基,然后羟基发生消去反应生成双键,则第一步反应反应的化学方程式为 。
。
(5)同时满足下列条件的F的同分异构体中①能发生银镜反应,含有醛基;②能与氯化铁溶液反应,含有酚羟基;③分子中只有1个甲基。则苯环上如果是两个取代基,应该是-OH和-CH(CH3)CHO,有邻间对3种;如果是三个取代基应该是-OH、-CHO和-CH2CH3或-OH、-CH3和-CH2CHO,在苯环上的位置均有10种,因此共计是23种;其中核磁共振氢谱有6组峰的结构简式为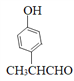 。
。
(6)根据逆推法结合已知信息可知以乙烯为原料制备强吸水性树脂![]() 的合成路线流程图为
的合成路线流程图为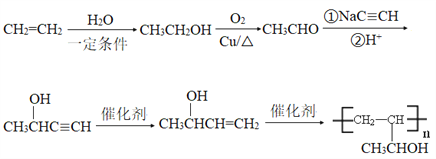 。
。

【题目】(1)将等体积、等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈_________(填“酸性”“碱性”或“中性”),溶液中[Na+]______[CH3COO-](填“>” “<”或“=”)。
(2)常温下,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后,溶液呈__________(填“酸性”“碱性”或“中性”),溶液中[Na+]______[CH3COO-](填“>” “<”或“=”)。
(3)物质的量浓度相等的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈_______________(填“酸性”“碱性”或“中性”),醋酸溶液的体积______(填“>” “<”或“=”)氢氧化钠溶液的体积。
(4)将mmol·L-1的醋酸和nmol·L-1的氢氧化钠溶液等体积混合后溶液的pH=7,则醋酸溶液中c(H+)_______氢氧化钠溶液中c(OH-)(填“>” “<”或“=”),m与n的大小关系式_____________________。
【答案】 碱性 > 酸性 < 中性 > < m>n
【解析】本题主要考查弱酸电离及其盐类水解。
(1)将等体积、等物质的量浓度的醋酸和氢氧化钠溶液混合后,形成醋酸钠溶液,醋酸钠水解使溶液呈碱性,溶液中电荷守恒:[H+]+[Na+]=[CH3COO-]+[OH-],且碱性溶液中,[H+]<[OH-],所以[Na+]>[CH3COO-]。
(2)醋酸难电离,常温下,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后,由于醋酸浓度较大而剩余,醋酸电离使溶液呈酸性,溶液中电荷守恒:[H+]+[Na+]=[CH3COO-]+[OH-],且酸性溶液中,[H+]>[OH-],所以[Na+]<[CH3COO-]。
(3)物质的量浓度相等的醋酸和氢氧化钠溶液混合后,溶液中电荷守恒:[H+]+[Na+]=[CH3COO-]+[OH-],由于溶液中醋酸根离子和钠离子浓度相等,所以[H+]=[OH-],则混合后溶液呈中性,与(1)比较可知醋酸溶液的体积>氢氧化钠溶液的体积。
(4)将mmol·L-1的醋酸和nmol·L-1的氢氧化钠溶液等体积混合后溶液的pH=7,由于醋酸难电离,则醋酸溶液中c(H+)<氢氧化钠溶液中c(OH-),与(1)比较可知m与n的大小关系式为m>n。
【题型】填空题
【结束】
23
【题目】某温度(T℃)下的溶液中,[H+]=10-xmol·L-1,[OH-]=10-y mol·L-1,x与y的关系如图所示,请回答下列问题:

(1)此温度下,水的离子积KW=______________,则该温度T________25℃(填“>” “<”或“=”)。
(2)在此温度下,向Ba(OH)2溶液中逐滴加入pH=a的盐酸,测得混合溶液的部分pH 如下表所示:
实验序号 | Ba(OH)2溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
① | 22.00 | 0.00 | 8 |
② | 22.00 | 18.00 | 7 |
③ | 22.00 | 22.00 | 6 |
假设溶液混合前后的体积变化忽略不计,则a=________, 实验②中由水电离产生的[OH-]=______mol·L-1。
(3)在此温度下,将0.1mol·L-1的NaHSO4溶液与0.1mol·L-1的Ba(OH)2溶液按下表中甲、乙、丙、丁不同方式混合:
甲 | 乙 | 丙 | 丁 | |
0.1 mol·L-1Ba(OH)2溶液体积/mL | 10 | 10 | 10 | 10 |
0.1 mol L-l NaHSO4溶液体积/mL | 5 | 10 | 15 | 20 |
①按丁方式混合后,所得溶液显__________性(填“酸”“碱”或“中”)。
②写出按乙方式混合后,反应的离子方程式:____________________ 。
③按甲方式混合后,所得溶液的pH 为_____________。
(4)在25 ℃下,将a mol·L-1的NaCN溶液与0.01mol·L-1的盐酸等体积混合,反应后测得溶液pH=7,则a________(填“>” “<”或“=”)0.01;用含a的代数式表示HCN 的电离常数Ka=___________。