题目内容
【题目】(1)利用反应Cu+2FeCl3=CuCl2+2FeCl2设计成如图所示原电池,回答下列问题:
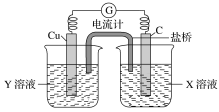
①写出电极反应式:正极___________________;负极_________________。
②图中X溶液是________,Y溶液是________。
③原电池工作时,盐桥中的________(填“阳”或“阴”)离子向X溶液方向移动。

(2)控制适合的条件,将反应2Fe3++2I-![]() 2Fe2++I2,设计成如图所示的原电池。
2Fe2++I2,设计成如图所示的原电池。
请回答下列问题:
反应开始时,乙中石墨电极上发生____________(填“氧化”或“还原”)反应,电极反应式为________________。甲中石墨电极上发生______________反应,电极反应式为___________。
②电流计读数为0时,反应达到平衡状态,此时在甲中加入FeCl2固体,则乙中的石墨作___________(填“正”或“负”)极,该电极的电极反应式为____________________。
(3)利用反应2Cu+O2+2H2SO4=2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为_____________________________。
【答案】(1)①2Fe3++2e-=2Fe2+、Cu-2e-=Cu2+②FeCl3、CuCl2③阳
(2)①氧化、2I--2e-=I2、还原、2Fe3++2e-=2Fe2+
②正、I2+2e-=2I-(3)O2+4e-+4H+=2H2O
【解析】
试题分析:(1)①原电池中正极得到电子,则根据方程式可知正极是铁离子得到电子,正极电极反应式为2Fe3++2e-=2Fe2+;负极是铜失去电子,电极反应式为Cu-2e-=Cu2+。
②图中碳棒是正极,铜棒是负极,因此X溶液是FeCl3,Y溶液是CuCl2。
③原电池工作时溶液中的阳离子向正极移动,因此盐桥中的阳离子向X溶液方向移动。
(2)①碘离子失去电子,则乙中石墨是负极,所以反应开始时,乙中石墨电极上发氧化反应,电极反应式为2I--2e-=I2。甲中石墨电极上发生还原反应,电极反应式为2Fe3++2e-=2Fe2+。
②电流计读数为0时,反应达到平衡状态,此时在甲中加入FeCl2固体,平衡向逆反应方向进行,则乙中的石墨正极,该电极的电极反应式为I2+2e-=2I-。
(3)根据方程式可知氧气得到电子,所以氧气在正极放电,溶液显酸性,则电极反应式为O2+4e-+4H+=2H2O。