题目内容
赤铜矿的主要成分是Cu2O,辉铜矿的主要成分是Cu2S。赤铜矿与辉铜矿混合加热发生以下反应:Cu2S+2Cu2O=6Cu+SO2。下列说法正确的是( )
| A.该反应的氧化剂只有Cu2O |
| B.Cu2S在反应中既是氧化剂,又是还原剂 |
| C.Cu既是氧化产物又是还原产物 |
| D.每生成19.2 g Cu,反应中转移1.8 mol电子 |
B
解析

练习册系列答案
相关题目
在下列变化中,需要加入合适的氧化剂才能实现的是
| A.HCl→H2 | B.CO2→CO | C.Fe2O3→Fe | D.Br-→Br 2 |
以下有关实验原理及结论正确的是( )
| A.XCl3的溶液能与铜片发生反应,则铜的金属性一定比X强 |
| B.金属X能与NaOH溶液反应放出H2,但金属Y不能,则Y的金属性一定比X弱 |
| C.非金属X能将Fe氧化到+3价,但非金属Y不能,则Y的氧化性一定比X强 |
| D.Na2SO3溶液使酸性KMnO4溶液褪色:5SO32—+6H++2MnO4—=5SO42—+2Mn2++3H2O |
前几年,部分巨能钙被检出含有双氧水,而双氧水有致癌性,可加速人体衰老。因此卫生部加紧调查巨能钙。下列有关说法错误的是( )
| A.H2O2、Na2O2都属于过氧化物,都存在共价键 |
| B.双氧水是绿色氧化剂,可作医疗消毒剂 |
| C.H2O2既有氧化性,又有还原性,与Cl2、KMnO4反应是表现H2O2的氧化性 |
| D.H2O2做漂白剂是利用其氧化性,漂白原理与HClO类似,与SO2不同 |
反应①、②分别是从海藻灰和某种矿石中提取碘的主要反应:
①2NaI+MnO2+3H2SO4=2NaHSO4+MnSO4+2H2O+I2
②2NaIO3+5NaHSO3=2Na2SO4+3NaHSO4+H2O+I2
下列说法正确的是( )
| A.两个反应中均为硫元素被氧化 |
| B.碘元素在反应①中被还原,在反应②中被氧化 |
| C.氧化性:MnO2>SO42—>IO3—>I2 |
| D.反应①、②中生成等量的I2时转移电子数比为1∶5 |
下列说法正确的是 ( )。
A.根据反应Cu+H2SO4 CuSO4+H2↑可推出Cu的还原性比H2的强 CuSO4+H2↑可推出Cu的还原性比H2的强 |
| B.在反应CaH2+2H2O=Ca(OH)2+2H2↑中,水作氧化剂 |
| C.反应3NO2+H2O=2HNO3+NO中氧化剂和还原剂的物质的量之比是3∶1 |
| D.因Cl2的氧化性强于I2的氧化性,所以置换反应I2+2NaClO3=2NaIO3+Cl2不能发生 |
将51.2 g Cu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物共0.8 mol,这些气体恰好能被500 mL 2 mol/L NaOH溶液完全吸收,发生的反应为:
2NO2+2NaOH=NaNO2+NaNO3+H2O; NO+NO2+2NaOH=2NaNO2+H2O。
则生成的盐溶液中NaNO2的物质的量为( )
| A.0.4 mol | B.0.6 mol | C.0.8 mol | D.0.2 mol |
向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示。有关说法不正确的是( )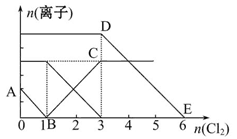
| A.线段BC代表Fe3+物质的量的变化情况 |
| B.原混合溶液中c(FeBr2)="6" mol/L |
| C.当通入Cl2 2 mol时,溶液中已发生的离子反应可表示为:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl- |
| D.原溶液中n(Fe2+)∶n(I-)∶n(Br-)=2∶1∶3 |
下列说法正确的是( )。
A.根据反应Cu+H2SO4 CuSO4+H2↑可推出Cu的还原性比H2的强 CuSO4+H2↑可推出Cu的还原性比H2的强 |
| B.在反应CaH2+2H2O===Ca(OH)2+2H2↑中,水作氧化剂 |
| C.反应3NO2+H2O===2HNO3+NO中氧化剂和还原剂的物质的量之比是3∶1 |
| D.因Cl2的氧化性强于I2的氧化性,所以置换反应I2+2NaClO3===2NaIO3+Cl2不能发生 |