题目内容
【题目】氢气是清洁的能源,也是重要的化工原料。
(1)以H2为原料制取氨气进而合成CO(NH2)2的反应如下:
N2(g)+3H2(g)+CO2(g)===CO(NH2)2(s)+H2O(l) ΔH=179.38 kJ·mol1
已知: 2NH3(g)+CO2(g)===NH2CO2NH4(s) ΔH=159.47 kJ·mol1
NH2CO2NH4(s) ===CO(NH2)2(s)+H2O(l) ΔH=+72.49 kJ·mol1
则N2(g)+3H2(g) ===2NH3(g) ΔH= kJ·mol1。
(2)储氢材料领域是当前研究热点,LiBH4是一种良好的储氢材料。采用球磨法制备Al与LiBH4的复合材料,并对AlLiBH4体系与水反应产氢的特性进行下列研究:
①图甲为25℃水浴时每克不同配比的AlLiBH4复合材料与水反应产生H2体积随时间变化关系图。由图可知,下列说法正确的 (填字母)。
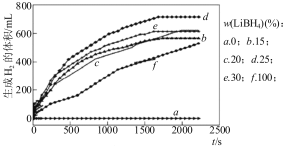

甲 乙
a.25℃时,纯LiBH4和铝均与水反应产生氢气
b.25℃时,复合材料中铝不能产生氢气,只是起到催化作用
c.25℃时,AlLiBH4复合材料中LiBH4含量25%,储氢效果最好
②图乙为25℃和75℃时,AlLiBH4复合材料[ω(LiBH4)=25%]与水反应一定时间后产物的X射线衍射图谱(X射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。从图分析,25℃时AlLiBH4复合材料中LiBH4与水反应生成的LiB(OH)4化学方程式为 ,铝元素的存在有多种形式,其中Al(OH)3产生的原因可能是 。
(3)已知H2S高温热分解制H2的反应为:H2S(g)![]() H2(g)+1/2S2(g)在恒容密闭容器中,控制不同温度进行H2S的分解实验,以H2S的起始浓度均为c mol·L1测定H2S的转化率,结果如下图所示:
H2(g)+1/2S2(g)在恒容密闭容器中,控制不同温度进行H2S的分解实验,以H2S的起始浓度均为c mol·L1测定H2S的转化率,结果如下图所示:

图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。若985℃时,反应经t min达到平衡,此时H2S的转化率为40%,则反应速率v(S2)= (用含c、t的代数式表示)。请说明随温度的升高,曲线b向曲线a逼近的原因: 。
(4)用惰性电极电解煤浆液的方法制H2的反应为:C(s)+2H2O(l) ===CO2(g)+2H2(g)现将一定量的1 mol·L1 H2SO4溶液和适量煤粉充分混合,制成含碳量为0.02 g·mL1~0.12g·mL1的煤浆液,置于如图所示装置中进行电解(两电极均为惰性电极)。则B极的电极反应式为 。

【答案】
(1)△H=―92.40 kJ·mol1(2分)
(2)①c(2分)
②LiBH4+4H2O===LiB(OH)4+ 4H2(2分) 反应生成LiOH使溶液呈碱性溶解铝(2分)
(3)0.2c/t mol·L1·min1(2分)
温度升高,反应速率加快,达到平衡所需的时间缩短(合理答案均可)(2分)
(4)2H++2e===H2↑(2分)
【解析】
试题分析:
(1)第一个方程式减去后两个即可得出该式的反应热;
(2)氧化还原反应:LiBH4+4H2O===LiB(OH)4+4H2 ,根据图像观察得出体系中含有氢氧化锂和硼酸锂,所以应是反应生成LiOH使溶液呈碱性溶解铝;
(3)反应经t min达到平衡,此时H2S的转化率为40%,反应中变化的浓度为0.4c mol·L1,S2是H2S变化一半,v(S2)=0.2c/t mol·L1·min1;温度升高,反应速率加快,达到平衡所需的时间缩短;
(4)B电极为阴极:2 H++2e===H2↑。

【题目】在2L密闭容器内,800℃时反应:2NO(g)+O2(g)![]() 2NO2(g)体系中,c(NO)随时间的变化如表:
2NO2(g)体系中,c(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)(mol/L) | 0.10 | 0.05 | 0.04 | 0.03 | 0.03 | 0.03 |
(1)分析上表,该反应达到平衡状态所需时间是_________。

(2)上图中表示NO2的浓度变化曲线是_______________。
(3)用NO表示从0~2s内该反应的平均速率v=________。
(4)v(NO):v(O2) = ______________。
(5)达到平衡状态时O2的转化率为________。



