题目内容
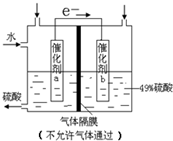 (2013?东城区二模)如图是将SO2转化为重要的化工原料H2SO4的原理示意图,下列说法不正确的是( )
(2013?东城区二模)如图是将SO2转化为重要的化工原料H2SO4的原理示意图,下列说法不正确的是( )分析:A.该装置没有外加电源,是一个原电池;
B.催化剂b表面O2发生还原反应生成H2O,消耗H+,其附近酸性减弱;
C.催化剂a表面是SO2失去电子生成硫酸;
D.总方程为:SO2+H2O+
O2 =H2SO4,先设加入的SO2的量和加入的水的量,再根据方程求出生成硫酸的量和消耗的水的量.
B.催化剂b表面O2发生还原反应生成H2O,消耗H+,其附近酸性减弱;
C.催化剂a表面是SO2失去电子生成硫酸;
D.总方程为:SO2+H2O+
| 1 |
| 2 |
解答:解:A.该装置没有外加电源,是一个原电池,把化学能转化为电能,故A正确;
B.催化剂b表面O2发生还原反应生成H2O,消耗H+,其附近酸性减弱,故B错误;
C.催化剂a表面是SO2失去电子生成硫酸,电极方程为:SO2+2H2O-2e-=SO42-+4H+,故C正确;
D.催化剂a处的反应为:SO2+2H2O-2e-=SO42-+4H+,
催化剂b处的反应为:
O2+2H++2e-=H2O
总方程为:SO2+H2O+
O2=H2SO4
设加入的SO2为xg,H2O为yg.
则生成硫酸的质量为:
水的质量变化为:y-
根据二者的比值为49%,可以求得
=
,故D正确;
故选B.
B.催化剂b表面O2发生还原反应生成H2O,消耗H+,其附近酸性减弱,故B错误;
C.催化剂a表面是SO2失去电子生成硫酸,电极方程为:SO2+2H2O-2e-=SO42-+4H+,故C正确;
D.催化剂a处的反应为:SO2+2H2O-2e-=SO42-+4H+,
催化剂b处的反应为:
| 1 |
| 2 |
总方程为:SO2+H2O+
| 1 |
| 2 |
设加入的SO2为xg,H2O为yg.
则生成硫酸的质量为:
| xg×98g/mol |
| 64g/mol |
水的质量变化为:y-
| xg×18g/mol |
| 64g/mol |
根据二者的比值为49%,可以求得
| x |
| y |
| 8 |
| 15 |
故选B.
点评:本题以二氧化硫制硫酸为知识背景,考查了原电池的原理和电极方程式的书写.

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案 小学学习好帮手系列答案
小学学习好帮手系列答案
相关题目