题目内容
11.100ml 6mol/L 硫酸与2g锌粒反应,在一定温度下为了减缓反应的速率,但又不影响生成氢气的总量,可向反应物中加入( )| A. | 少量碳酸钠固体 | B. | 少量硫酸铜固体 | C. | 硝酸钾溶液 | D. | 氯化钠溶液 |
分析 n(Zn)=$\frac{2g}{65g/mol}$=0.0308mol,n(H2SO4)=6mol/L×0.1L=0.6mol>0.0308mol,所以硫酸有剩余,为了减缓锌和稀硫酸的反应速率,可以采用降低硫酸浓度的方法,但不能影响生成氢气的总量,则改变条件时不能和锌反应,据此分析解答.
解答 解:n(Zn)=$\frac{2g}{65g/mol}$=0.0308mol,n(H2SO4)=6mol/L×0.1L=0.6mol>0.0308mol,所以硫酸有剩余,为了减缓锌和稀硫酸的反应速率,可以采用降低硫酸浓度的方法,但不能影响生成氢气的总量,则改变条件时不能和锌反应,
A.加入少量碳酸钠固体,碳酸钠和稀硫酸反应生成硫酸钠,导致氢离子浓度降低,反应速率降低,故A正确;
B.加入少量硫酸铜固体,Zn和铜离子发生置换反应生成Cu,所以生成氢气总量减少,故B错误;
C.加入硝酸钾溶液时,硝酸和锌反应生成氮氧化物而不是氢气,所以生成氢气质量减少,故C错误;
D.加入氯化钠溶液时,氢离子浓度降低,反应速率减小,但生成氢气质量不变,故D正确;
故选AD.
点评 本题考查化学反应速率影响因素,为高频考点,正确判断哪种物质过量是解本题关键,题目难度不大.

练习册系列答案
相关题目
20.铜是人类最早发现和使用的金属之一,铜及其合金的用途广泛.粗铜中含有少量铁、锌、镍、银、金等杂质,工业上可用电解法精炼粗铜制得纯铜,下列叙述正确的是( )(已知:氧化性Fe2+<Ni2+<Cu2+)
| A. | 粗铜作阳极,其电极反应式:Cu2++2e-=Cu | |
| B. | 电解过程中,电解质溶液中c(Cu2+)不变 | |
| C. | 电解后,阴极上还附有极少量的Fe和Ni | |
| D. | 电解后,可用阳极泥来提炼金、银等贵金属 |
1.将15.6g Na2O2和5.4gAl同时放入一定量的水中,充分反应后得到200mL溶液,再向该溶液中缓慢通入标准状况下的HCl气体8.96L,若反应过程中溶液体积保持不变,则( )
| A. | 反应过程中得到6.72 L的气体(标况) | |
| B. | 最终得到的溶液中c(Na+)=c(Cl-)+c(OH-) | |
| C. | 最终得到7.8 g的沉淀 | |
| D. | 最终得到的溶液中c(NaCl)=2.0 mol/L |
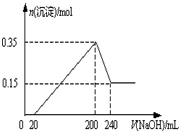 将一定质量的Mg和Al的混合物投入2.0mol/L,250mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入一定浓度的NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如右图所示.回答下列问题:
将一定质量的Mg和Al的混合物投入2.0mol/L,250mL稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入一定浓度的NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如右图所示.回答下列问题: