题目内容
11.下列各组有机物,无论以何种物质的量的比例混合,只要总物质的量一定,则完全燃烧消耗氧气的量及生成水的量均为一恒定值的是( )| A. | CH4和C2H4O2 | B. | C2H6O和C2H4 | C. | C3H6和C4H6 | D. | C2H2和C6H6 |
分析 根据题意可知,有机物无论以何种物质的量的比例混合,只要总物质的量一定,完全燃烧消耗氧气的量为一恒定值,可假设有机物的物质的量都为1mol,混合物中的两种有机物物质的量相同时,完全燃烧消耗的氧气的物质的量相等,无论以何种物质的量的比例混合,完全燃烧消耗氧气的量为一恒定值,根据消耗氧气的量为x+$\frac{y}{4}$(x为C原子数,y为H原子数)计算,如有机物中含有O原子,利用分子式拆写的方法计算.
解答 解:A、1molCH4完全燃烧消耗2mol氧气,1molC2H4O2,可以写成CH4•CO2,完全燃烧消耗2mol氧气,生成水都是2mol,所以二者相等,故A正确;
B、1molC2H6O完全燃烧消耗3mol氧气,1molC2H4完全燃烧消耗3mol氧气,但生成水的物质的量不相等,故B错误;
C、1molC3H6完全燃烧消耗4.5mol氧气,1molC4H6完全燃烧消耗5.5mol氧气,生成水的物质的量相等,故C错误;
D、1molC2H2完全燃烧消耗2.5mol氧气,1molC6H6完全燃烧消耗7.5mol氧气,消耗氧和生成水的量都不等,故D错误.
故选A.
点评 本题考查有机物耗氧量的计算,题目难度不大,注意题中等物质的量、完全燃烧消耗氧气的量为一恒定值等要求.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
2.下列有机物中,完全燃烧时生成的二氧化碳与水的物质的量之比为2:1的是( )
| A. | 乙烷 | B. | 乙烯 | C. | 乙炔 | D. | 乙醇 |
19.在下列各溶液中,一定能大量共存的一组离子是( )
| A. | 含有AlO2-的溶液中:Na+、Al3+、NO3-、Cl- | |
| B. | 使淀粉碘化钾变蓝的溶液中:K+、HCO3-、S2-、SO42- | |
| C. | 能与金属铝反应放出氢气的溶液中:K+、NO3-、Cl-、Na+ | |
| D. | 透明溶液中:Na+、MnO4-、Na+、SO42- |
6.据报道,已发现了第114号元素.下列关于其推测不正确的是( )
| A. | 它有+2,+3,+4价 | B. | 其晶体有良好的导电性 | ||
| C. | 其原子最外层上有4个电子 | D. | 该元素位于第七周期ⅣA族 |
16.将15.6g Na2O2和5.4g Al同时放入一定量的水中,充分反应后得到200mL溶液,再向该溶液中缓慢通入标准状况下的HCl气体6.72 L,若反应过程中溶液的体积保持不变,则下列说法正确的是( )
| A. | 标准状况下,反应过程中得到7.84 L的气体 | |
| B. | 最终得到的溶液中c(Na+)=c(Cl-)+c(OH-) | |
| C. | 最终得到7.8 g的沉淀 | |
| D. | 最终得到的溶液中c(Na+)=1.5 mol•L-1 |
3.下列离子方程式书写正确的是( )
| A. | 硫氢化钠的水解:HS-+H2O═S2-+H3O+ | |
| B. | Fe(OH)3溶于氢碘酸中:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | 钢铁发生吸氧腐蚀的负极反应式:O2+4e-+2H2O═4OH- | |
| D. | 碳酸氢铵溶液中滴入少量烧碱溶液:HCO3-+OH-═CO32-+H2O |
1.短周期主族元素X、Y、Z、W原子序数依次增大.已知:X、Z同主族,X、Y、Z三种元素原子的最外层电子数之和为15,Y原子最外层电子数等于X原子最外层电子数的一半.下列叙述正确的是( )
| A. | 原子半径:X<W<Y<Z | |
| B. | X的氢化物稳定性大于Z的氢化物稳定性 | |
| C. | X在自然界中只能以化合态形式存在 | |
| D. | W的单质可使干燥的红色布条褪色 |
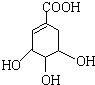
 ),其反应类型是消去反应.
),其反应类型是消去反应.
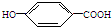
 +H2O.
+H2O.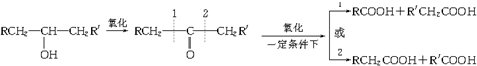
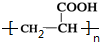 ,H
,H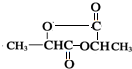 .
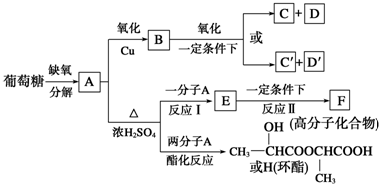
.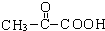 +2H2O;A-→ECH3CH(OH)COOH$→_{△}^{浓硫酸}$CH2=CHCOOH+H2O.
+2H2O;A-→ECH3CH(OH)COOH$→_{△}^{浓硫酸}$CH2=CHCOOH+H2O.