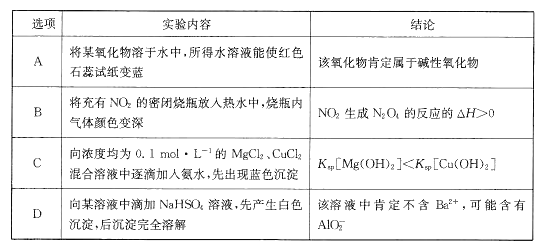
题目内容
【题目】尿素是一种重要的氮肥,它的合成主要发生以下2步反应:
反应1:2NH3(g)+CO2(g) ![]() NH4COONH2(1) △H1=a kJ·mol-1
NH4COONH2(1) △H1=a kJ·mol-1
反应2:NH4COONH2(1)=====NH2CONH2(1)+H2O(1) △H2=b kJ·mol-1
回答下列问题:
(1)写出合成尿素的热化学方程式:_____________________(用含a、b的代数式表示)。写出一种可以提高NH3平衡转化率的措施:_______________________________。
(2)95℃时,在2L恒容密闭容器中加入3mol氨气和1molCO2使之充分反应合成尿素,达到平衡时,CO2的转化率为60%,则此温度下合成尿素的平衡常数是________________(保留2位小数)。
(3)下表为反应1和反应2在不同温度下达到平衡时所测得的平衡常数(K)的数据。
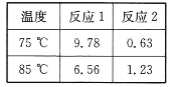
①从上表数据可推出b_____(填“>”或“<”)0,理由是______________________。
②升高温度,反应1的反应速率将_________(填“增大”或“减小”)。
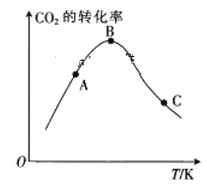
③下图是合成尿素时温度对二氧化碳转化率的影响曲线。从图中可知A、B、C三点对应的温度下该反应的平衡常数大小关系是_________________(用KA、KB、KC表示)。
【答案】2NH3(g)+CO2(g)![]() H2NCONH2(l)+H2O(l) △H=(a+b)kJ·mol-1 增大CO2的通入量或适当增大体系压强 6.17 > 升高温度,平衡常数变大,平衡正向移动,说明正反应是吸热反应 增大 KA>KB>KC
H2NCONH2(l)+H2O(l) △H=(a+b)kJ·mol-1 增大CO2的通入量或适当增大体系压强 6.17 > 升高温度,平衡常数变大,平衡正向移动,说明正反应是吸热反应 增大 KA>KB>KC
【解析】
(1)反应1+反应2得出2NH3(g)+CO2(g)![]() H2NCONH2(l)+H2O(l) △H=△H1+△H2=(a+b)kJ·mol-1;要提高NH3的平衡转化率,应使平衡向正反应方向进行,可能的措施不:增大CO2的通入量或适当增大体系压强等;
H2NCONH2(l)+H2O(l) △H=△H1+△H2=(a+b)kJ·mol-1;要提高NH3的平衡转化率,应使平衡向正反应方向进行,可能的措施不:增大CO2的通入量或适当增大体系压强等;
(2)2NH3(g)+CO2(g)![]() H2NCONH2(l)+H2O(l)
H2NCONH2(l)+H2O(l)
起始: 3 1
变化: 1.2 0.6
平衡: 1.8 0.4 达到平衡时,c(CO2)=0.2mol·L-1,c(NH3)=0.9mol·L-1,根据平衡常数的表达式K=1/[c2(NH3)·c(CO2)]≈6.17;
(3)①根据反应2,升高温度,化学平衡常数增大,说明升高温度平衡向正反应方向进行,根据勒夏特里原理,△H>0,即b>0;
②升高温度,化学反应速率增大;
③B点以后,升高温度,CO2的转化率降低,说明平衡向逆反应方向进行,正反应方向为放热反应,化学平衡常数只受温度的影响,该反应中升高温度,化学平衡常数降低,即KA>KB>KC;