题目内容
【题目】完成下列实验所需选择的装置或仪器都正确的是 ( )
A. 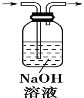 除去CO2气体中的HCl气体
除去CO2气体中的HCl气体
B. 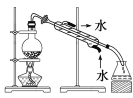 除去氯化钠晶体中混有的氯化铵晶体
除去氯化钠晶体中混有的氯化铵晶体
C. 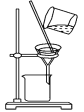 分离CCl4中的Br2
分离CCl4中的Br2
D. 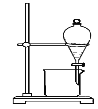 分离植物油和氯化钠溶液
分离植物油和氯化钠溶液
【答案】D
【解析】
A、CO2和NaOH溶液反应生成碳酸钠或碳酸氢钠,在用氢氧化钠除去二氧化碳中氯化氢的同时,会将二氧化碳除去,不能达到目的,故A错误;
B、除去氯化钠晶体中混有的氯化铵晶体,可用加热的方法,氯化铵在加热条件下易分解,不能用蒸馏的方法,故B错误;
C、分离CCl4中的Br2应用蒸馏的方法,不能用过滤的方法,二者互溶,但沸点不同,故C错误;
D、由相似相溶原理可知,植物油与氯化钠溶液互不相溶,可以采用分液的方法进行分离,故D正确;
答案选D。

【题目】环己酮是重要的化工原料,也是重要的工业溶剂。实验室制备环己酮的原理、有关数据及装置示意图如下:
反应原理:
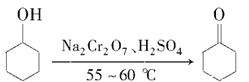
反应放热,温度过高或者重铬酸钠过量会进一步氧化.
主要物料及产物的物理参数:
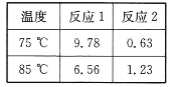
名称 | 溶解度 | 密度 | 熔点℃ | 沸点℃ | 溶解度 | |
水 | 乙醚 | |||||
环己醇 | 无色,有刺激性气味 | 0.9624 | 25.93 | 161.5 | 5.67g/100mL |
|
环己酮 | 无色,有枣激性气味 | 0.9478 | —— | 155.7 | 2.4g/100mL |
|
实验装置:
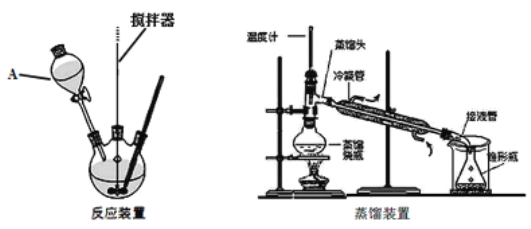
实验步骤:
①投料:在100mL三颈烧瓶中加入20mL水,慢慢加入5mL浓硫酸摇动,振荡下缓慢加入5mL(4.8g,0.048mol)环己醇,并将混合液温度降至30℃以下。将5g(0.019mol)重铬酸钠溶于水得橙红色溶液备用.
②反应:将约1/5的重铬酸钠溶液加入三颈烧瓶中,充分搅拌使之混合均匀。冷水浴冷却,控制反应温度在55-60℃。待橙红色消失后,再将剩余的重铬酸钠溶液分四次加入到三颈烧瓶中,当温度自动下降时,加入4mL甲醇使反应液完全变成墨绿色(三价铬);
③蒸馏:在反应瓶中加入30mL水,并改为蒸馏装置,收集90-99℃之间的馏分(环己酮与水的共沸物)至无油珠为止;
④萃取、干燥:将馏出液用食盐饱和后转入分液漏斗中,分出有机层。水层用8mL乙醚提取一次,将乙醚提取液和有机层合并,用无水硫酸镁干燥;5.蒸馏,收集环己酮产品2.6g。
请回答下列问题:
(1)装置A的名称是
(2)完成并配平反应方程式:
_____![]() +_____Na2Cr2O7+____H2SO4→____
+_____Na2Cr2O7+____H2SO4→____![]() +____Na2SO4+____Cr2(SO4)3+___H2O___________
+____Na2SO4+____Cr2(SO4)3+___H2O___________
(3)反应过程中加入甲醇后有无色气体生成。加入甲醇的作用是______,请用离子方程式表示反应原理________.
(4)步骤4向馏出液加入食盐的目的是_________,将乙醚提取液和有机层合并的原因是_________.