题目内容
【题目】H2是一种清洁能源。在冶金、电力、材料等领域应用广泛。请回答下列问题:
(1)某科研团队利用透氧膜获得N2、H2的工作原理如图甲所示(空气中N2与O2的物质的量之比按4:1计)。上述过程中,膜I侧所得气体的物质的量之比n(H2):n(N2)=3:1,则CH4、H2O与O2反应的化学方程式为______________________。

(2)用H2和CO合成甲醇的热化学方程式为CO(g)+2H2(g) ![]() CH3OH (g) △H1。已知:CO2(g)+3H2(g)==CH3OH(g)+H2O(g) △H2=-49.0kJ·mol-1;CO(g)+H2O(g)==CO2(g)+H2(g) △H3=-41.1k J·mol-1.则△H1=___________ k J·mol-1。
CH3OH (g) △H1。已知:CO2(g)+3H2(g)==CH3OH(g)+H2O(g) △H2=-49.0kJ·mol-1;CO(g)+H2O(g)==CO2(g)+H2(g) △H3=-41.1k J·mol-1.则△H1=___________ k J·mol-1。
(3)向容积可变的密闭容器中充入1 mol CO和2.2molH2,在恒温恒压条件下发生反应CO(g)+2H2(g)![]() CH3OH(g),平衡时,CO的转化率[α(CO)]随温度、压强的变化情况如图乙所示。
CH3OH(g),平衡时,CO的转化率[α(CO)]随温度、压强的变化情况如图乙所示。

①压强:p1___________(填“>”<”或“=”)p2。
②M点时,H2的转化率为___________(计算结果精确到0.1%),该反应的平衡常数Kp=___________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③不同温度下,该反应的平衡常数的对数值(lgK)如图丙所示,其中,A点为506K时平衡常数的对数值,则B、C、D、E四点中能正确表示该反应的lgK与温度(T)的关系的是___________。
(4)H2还原NO的反应为2NO(g)+2H2(g)![]() N2(g)+2H2O(1),实验测得反应速率的表达式为v=kcm(NO)·cn(H2)(k是速率常数,只与温度有关)
N2(g)+2H2O(1),实验测得反应速率的表达式为v=kcm(NO)·cn(H2)(k是速率常数,只与温度有关)
①某温度下,反应速率与反应物浓度的变化关系如下表所示。
编号 | c(H2)/(mol/L) | c(NO)/(mol/L) | v/(mol/Lmin) |
1 | 0.10 | 0.10 | 0.414k |
2 | 0.10 | 0.20 | 1.656k |
3 | 0.50 | 0.10 | 2.070k |
由表中数据可知,m=___________,n=___________。
②上述反应分两步进行:i.2NO(g)+H2(g)==N2(g)+H2O2(1)(慢反应);ii.H2O2(1)+H2(g)==2H2O(1)(快反应)。下列叙述正确的是___________(填字母)
A.H2O2是该反应的催化剂
B.反应i的活化能较高
C.总反应速率由反应ii的速率决定
D.反应i中NO和H2的碰撞仅部分有效
【答案】14CH4+12H2O+O2=14CO+40H2 -90.1 > 54.5% ![]() B点和E点 2 1 BD
B点和E点 2 1 BD
【解析】
(1)空气中N2和O2的物质的量之比约为4:1,膜Ⅰ侧所得气体中![]() ,氮气的量在反应前后不变,设氮气为4mol,则生成氢气是12mol,由膜Ⅰ侧反应可知,12mol水得到电子,1mol氧气得到电子,膜Ⅰ上发生反应:12H2O+24e-=12H2+12O2-、O2+4e-=2O2-,膜Ⅱ上14molCH4中C失去84mol电子、H得到56mol电子时,总反应遵守电子守恒,则反应为14CH4+12H2O+O2=14CO+40H2。
,氮气的量在反应前后不变,设氮气为4mol,则生成氢气是12mol,由膜Ⅰ侧反应可知,12mol水得到电子,1mol氧气得到电子,膜Ⅰ上发生反应:12H2O+24e-=12H2+12O2-、O2+4e-=2O2-,膜Ⅱ上14molCH4中C失去84mol电子、H得到56mol电子时,总反应遵守电子守恒,则反应为14CH4+12H2O+O2=14CO+40H2。
(2)设已知反应方程式分别为a和b,则所求CO(g)+2H2(g) ![]() CH3OH(g)方程式c=a+b,则ΔH1=ΔH2+ΔH3=-90.1kJ·mol-1。
CH3OH(g)方程式c=a+b,则ΔH1=ΔH2+ΔH3=-90.1kJ·mol-1。
(3)①CO(g)+2H2(g)![]() CH3OH(g)是气体体积减小的反应,增大压强,平衡向右移动,CO的转化率会变大,结合图像乙,保持温度不变,转化率大的表示压强大,所以p1>p2;
CH3OH(g)是气体体积减小的反应,增大压强,平衡向右移动,CO的转化率会变大,结合图像乙,保持温度不变,转化率大的表示压强大,所以p1>p2;
②该问可用三段式解决,M点α(CO)=60%,则CO转化了1mol×60%=0.6mol,下面列三段式:
CO(g) + 2H2(g)![]() CH3OH(g)
CH3OH(g)
起始量 1mol 2.2mol 0
转化量 0.6mol 1.2mol 0.6mol
平衡量 0.4mol 1mol 0.6mol
可知,H2转化了1.2mol,则H2的转化率为1.2mol/2.2mol×100%=54.5%;由上列式可知平衡时总物质的量n=(0.4+1+0.6)mol=2mol,Kp=![]() =
=![]() =
=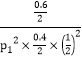 =
=![]() 。
。
③该反应为放热反应,当温度越高时,平衡常数K越小,则lgK也会越小,也就是T与lgK呈反比,所以B点和E点符合lgK与温度(T)的关系。
(4)①保持H2的浓度不变,则![]() ,带入编号1和编号2数据,得
,带入编号1和编号2数据,得![]() ,得m=2,保持N2的浓度不变,则
,得m=2,保持N2的浓度不变,则![]() ,带入编号1和编号3数据,得
,带入编号1和编号3数据,得![]() ,解得n=1;
,解得n=1;
②A.H2O2参与两个反应,但第一步未做反应物,因而不是催化剂,实际上H2O2仅仅是中间产物,A项错误;
B.反应i是慢反应,说明反应速率小,在其他条件一样的情况下,活化能比较高,B项正确;
C.总反应速率由慢反应决定,即反应(1),C项错误;
D.碰撞理论指出能发生化学反应的碰撞是指有效碰撞,即需要一定的能量和取向的碰撞,所以在所有碰撞中部分是有效地,D项正确。
故答案选BD。




