题目内容
【题目】下图Ⅰ、Ⅱ、Ⅲ是常见的气体发生装置;V、VI是气体收集装置,根据要求回求答下列问题:
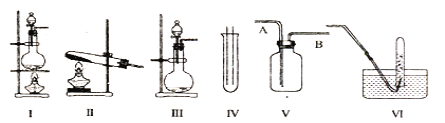
(1)气体发生装置的选择:若用CaCO3与盐酸反应制CO2,则可选择_________(填序号);若用I装置制取氯气,则浓盐酸应盛放在__________(填I中的仪器名称)。写出实验室制取氯气的化学方程式_________________________________________。
(2)收集装置的选择:若选用V为氯气收集装置,则氯气应从__________口通入。
(3)实验室制取氯气,多余的氯气要进行尾气处理,一般将尾气通入到氢氧化钠溶液中,其发生反应的离子方程式为________________________________________。
(4)气体的吸收:若标准状况下1体积的水已吸收336体积的HCl,且得到的溶液的密度为1.08g/cm3,则所得溶液中溶质的物质的量浓度为________mol/L。(保留一位小数)

(5)实验室用右图装置(夹持及加热仪器已略)制备氯气并进行一系列相关实验。
①装置B中饱和食盐水的作用是___________;
②设计装置D、E的目的是比较氯、溴、碘单质的氧化性强弱。当向D中缓缓通入少量氯气时,可以看到无色溶液逐渐变为___________色,打开活塞,将装置D中少量溶液加入装置E中,振荡。观察到的现象是溶液分为两层,下层为 ___________色
③装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入________。
a | b | c | d | |
Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
Ⅱ | 碱石灰 | 无水氯化钙 | 浓硫酸 | 无水氯化钙 |
Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
【答案】 III 分液漏斗 MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O A Cl2+2OH-==Cl-+ClO-+H2O 10.5 除去Cl2中的HCl 黄(橙黄,橙) 紫红(紫) d
MnCl2+Cl2↑+2H2O A Cl2+2OH-==Cl-+ClO-+H2O 10.5 除去Cl2中的HCl 黄(橙黄,橙) 紫红(紫) d
【解析】(1)若用CaCO3与盐酸反应制CO2,为固体和液体的反应,常温下可进行,可选择Ⅲ装置,用I装置制取氯气,浓盐酸放在分液漏斗中,浓盐酸和二氧化锰在加热条件下反应生成氯气、氯化锰和水,反应的方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;(2)氯气的密度大于空气的密度,所以应采用向上排空气法收集氯气,故A为进气口;(3)氯气与氢氧化钠溶液发生反应的离子方程式为Cl2+2OH-==Cl-+ClO-+H2O。(4)1体积的水吸收336体积的HCl,可设水的体积为1L,HCl的体积为336L,标准状况下336LHCl的物质的量为:336L÷22.4L/mol=15mol,质量为m=nM=36.5g/mol×15mol=547.5g,则所得盐酸溶液中溶质的质量分数为w=547.5g/(1000g+547.5g)×100%≈35.4%,所以溶质的物质的量浓度为:c=1000×1.08×35.4%/36.5mol/L≈10.5mol/L;(5)①生成的氯气中含有挥发出来的氯化氢,氯化氢极易溶于水,则装置B中饱和食盐水的作用是除去Cl2中的HCl;②当向D中缓缓通入少量氯气时溴化钠被氧化为单质溴,单质溴易溶在有机溶剂中,因此可以看到无色溶液逐渐变为黄(橙黄,橙)色;打开活塞,将装置D中少量溶液加入装置E中,单质溴能把碘化钾氧化为单质碘,碘易溶在有机溶剂中,且四氯化碳的密度大于水,所以振荡,观察到的现象是溶液分为两层,下层(四氯化碳)为紫红(紫)色;③装置C的实验目的是验证氯气是否具有漂白性,验证氯气是否具有漂白性,要验证干燥氯气无漂白性,湿润的有色布条中氯气和水反应生成次氯酸具有漂白性,选项中abc的Ⅱ中都是干燥剂,且碱石灰能与氯气反应,因此再通入湿润的有色布条不能验证氯气的漂白性,所以C中I、II、III依次放入湿润的有色布条、无水氯化钙、干燥的有色布条,答案选d;
MnCl2+Cl2↑+2H2O;(2)氯气的密度大于空气的密度,所以应采用向上排空气法收集氯气,故A为进气口;(3)氯气与氢氧化钠溶液发生反应的离子方程式为Cl2+2OH-==Cl-+ClO-+H2O。(4)1体积的水吸收336体积的HCl,可设水的体积为1L,HCl的体积为336L,标准状况下336LHCl的物质的量为:336L÷22.4L/mol=15mol,质量为m=nM=36.5g/mol×15mol=547.5g,则所得盐酸溶液中溶质的质量分数为w=547.5g/(1000g+547.5g)×100%≈35.4%,所以溶质的物质的量浓度为:c=1000×1.08×35.4%/36.5mol/L≈10.5mol/L;(5)①生成的氯气中含有挥发出来的氯化氢,氯化氢极易溶于水,则装置B中饱和食盐水的作用是除去Cl2中的HCl;②当向D中缓缓通入少量氯气时溴化钠被氧化为单质溴,单质溴易溶在有机溶剂中,因此可以看到无色溶液逐渐变为黄(橙黄,橙)色;打开活塞,将装置D中少量溶液加入装置E中,单质溴能把碘化钾氧化为单质碘,碘易溶在有机溶剂中,且四氯化碳的密度大于水,所以振荡,观察到的现象是溶液分为两层,下层(四氯化碳)为紫红(紫)色;③装置C的实验目的是验证氯气是否具有漂白性,验证氯气是否具有漂白性,要验证干燥氯气无漂白性,湿润的有色布条中氯气和水反应生成次氯酸具有漂白性,选项中abc的Ⅱ中都是干燥剂,且碱石灰能与氯气反应,因此再通入湿润的有色布条不能验证氯气的漂白性,所以C中I、II、III依次放入湿润的有色布条、无水氯化钙、干燥的有色布条,答案选d;

 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案