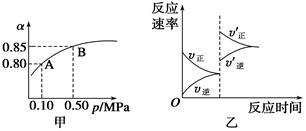
题目内容
将2 mol SO2和2 mol SO3气体混合于某固定体积的密闭容器中,在一定条件下反应:2SO2(g)+O2(g) 2SO3(g),平衡时SO3为W mol。相同温度下,分别按下列配比在相同体积的容器中反应,反应达到平衡时,SO3的物质的量大于W mol的是( )
2SO3(g),平衡时SO3为W mol。相同温度下,分别按下列配比在相同体积的容器中反应,反应达到平衡时,SO3的物质的量大于W mol的是( )
A.2 mol SO2+1 mol O2 B.4 mol SO2+1 mol O2
C.2 mol SO2+1 mol O2+2 mol SO3 D.3 mol SO2+1 mol SO3
C
【解析】原平衡相当于是4 mol SO2和1 mol O2,A相当于降低SO2的浓度,氧气转化率降低,平衡时SO3的物质的量小于W mol。B和原平衡是等效的,三氧化硫的浓度不变。C相当于是,4 mol SO2和2 mol O2,因此增大氧气的浓度,SO2的转化率增大,反应达到平衡时,SO3的物质的量大于W mol。D相当于4 mol SO2+0.5mol O2,即降低了氧气的浓度,转化率降低,平衡时SO3的物质的量小于W mol。所以答案选C。

 步步高达标卷系列答案
步步高达标卷系列答案(14分) 硫酸是工业生产中一种重要的化工产品,我国工业生产硫酸的主要方法是接触法,主要原料为黄铁矿,请回答下列问题:
(1)已知煅烧黄铁矿的化学方程式为 4FeS2 + 11O2
该反应中氧化剂和氧化产物之比为 ;标准状态下得到4.48升SO2 时,一共转移了 mol e-。(每空3分)
(2)已知温度、压强对SO2平衡转化率的影响如下表所示:根据上表回答,SO2转化到SO3的
最佳反应条件是 。(每空2分)
| A.400-500℃ 0.1 MPa | B.400℃10 MPa |
| C.500℃10 MPa | D.400-500℃1 MPa |
(4)市售浓硫酸的密度是1.84 g / cm3、质量分数为98 % ,若用H2SO4· XH2O来表示这种浓硫酸,则X为 。(每空2分)
 2SO3(g),下列哪些量不再变化时,并不能说明化学反应已达平衡状态( )
2SO3(g),下列哪些量不再变化时,并不能说明化学反应已达平衡状态( )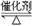 2SO3(g) ΔH<0。某温度下,将2 mol SO2和
2SO3(g) ΔH<0。某温度下,将2 mol SO2和