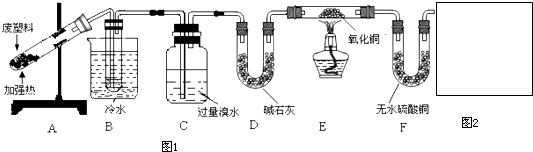
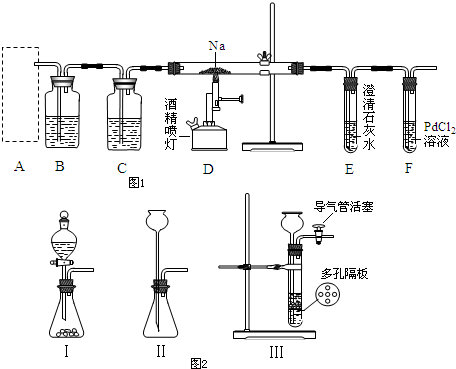
题目内容
在常温下,某兴趣小组模拟“侯氏制碱法”制取碳酸钠,流程如下: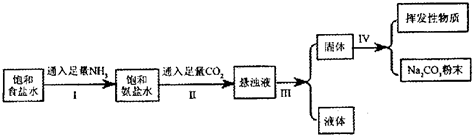
在常温下,有关物质的溶解度为:
| 物质 | NH4Cl | NaHCO3 | Na2CO3 | NaCl |
| 溶解度/g | 37.2 | 9.6 | 21.5 | 36.0 |
(2)操作I和操作II总反应的离子方程式为
(3)操作I和II不能颠倒的原因
(4)检验所得的碳酸钠粉末是否含有NaHCO3,的实验方案是(写出操作步骤、现象、结论):
(5)为了测定所制取产物的纯度(假设杂质只有碳酸氢钠).该小组的实验步骤为:
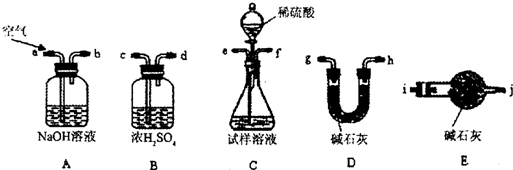
i.使用下列装置组装实验装置,并检查气密性;
ii.称取Wg产品放入C装置的锥形瓶中,加适量蒸馏水溶解
iii.称量D装置的质量为W1g
iv.从分液漏斗滴入稀硫酸,直到不再产生气体为止
v.从a处缓缓鼓入一定量的空气,再次称量D装置质量为W2g.
vi.重复步骤v的操作,直到D装置的质量不再改变,称得D装置的质量为W3g.
根据上述实验回答如下问题:
①第i步,使用上述装置连接的接口顺序为:(b)→(e)(f)→
②产物中碳酸钠的质量分数为(数字可不必化简)
分析:(1)把固体与液体所形成混合物中固体分离出来的方法为过滤,据此分析解答;
(2)根据溶解度表可知,碳酸氢钠的溶解度比碳酸钠小,经过操作I和操作II,溶液中离子反应的本质为二氧化碳和水结合生成碳酸,氨气和水结合生成一水合氨,碳酸和一水合氨反应,钠离子和碳酸氢根离子结合生成碳酸氢钠沉淀;
(3)二氧化碳在水中的溶解度小,与水反应形成不稳定的碳酸,而把二氧化碳通入溶有氨气而呈碱性的水中,会使生成的碳酸与氨水发生反应,而增大二氧化碳气体的吸收,所以操作I和II不能颠倒;
(4)根据碳酸钠和碳酸氢钠的性质差异进行解答,碳酸氢钠受热易分解;
(5)①测定所制取产物的纯度(假设杂质只有碳酸氢钠),需将碳酸钠和碳酸氢钠变为二氧化碳,通过碱石灰吸收来测量,因空气中有二氧化碳,所以需先除掉空气中的二氧化碳,将装置中的产生二氧化碳排净,据此分析连接装置;
②根据碳原子守恒和质量守恒进行计算.
(2)根据溶解度表可知,碳酸氢钠的溶解度比碳酸钠小,经过操作I和操作II,溶液中离子反应的本质为二氧化碳和水结合生成碳酸,氨气和水结合生成一水合氨,碳酸和一水合氨反应,钠离子和碳酸氢根离子结合生成碳酸氢钠沉淀;
(3)二氧化碳在水中的溶解度小,与水反应形成不稳定的碳酸,而把二氧化碳通入溶有氨气而呈碱性的水中,会使生成的碳酸与氨水发生反应,而增大二氧化碳气体的吸收,所以操作I和II不能颠倒;
(4)根据碳酸钠和碳酸氢钠的性质差异进行解答,碳酸氢钠受热易分解;
(5)①测定所制取产物的纯度(假设杂质只有碳酸氢钠),需将碳酸钠和碳酸氢钠变为二氧化碳,通过碱石灰吸收来测量,因空气中有二氧化碳,所以需先除掉空气中的二氧化碳,将装置中的产生二氧化碳排净,据此分析连接装置;
②根据碳原子守恒和质量守恒进行计算.
解答:解:(1)二氧化碳通入氨化的饱和氯化钠溶液中反应生成碳酸氢钠晶体,反应的化学方程式:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl,操作Ⅲ中的实验操作目的是将沉淀和溶液分开,所以通过过滤,可把混在溶液中的碳酸氢钠晶体分离出来,
故答案为:过滤;
(2)因为氨气的溶解度比二氧化碳大得多,且溶液呈碱性,有利于二氧化碳的吸收;所以操作I先通入足量的氨气,操作II将二氧化碳通入氨化的饱和氯化钠溶液中,根据溶解度表可知,碳酸氢钠的溶解度比碳酸钠小,所以发生NH3+CO2+H2O═NH4HCO3;NH4HCO3+NaCl═NaHCO3↓+NH4Cl,本质为Na++NH3+CO2+H2O═NaHCO3↓+NH4+,
故答案为:Na++NH3+CO2+H2O═NaHCO3↓+NH4+;
(3)二氧化碳微溶于水,先通入二氧化碳,溶液中生成极少量的碳酸,再通入氨气,生成的产物量少,且易生成碳酸铵,氨气在水中溶解度很大,先通入氨气,溶液中生成较多的一水合氨,再通入CO2,生成的产物量多,且易生成碳酸氢铵,
故答案为:由于NH3在饱和NaCl溶液中溶解量比CO2大,先通NH3,溶液呈碱性,更易吸收CO2,有利NaHCO3的生成;所以应先通入NH3;
(4)碳酸氢钠受热易分解,如果碳酸钠中含有碳酸氢钠,取少量产物于试管,加热发生2NaHCO3
Na2CO3+H2O+CO2↑,将产生的气体通入澄清石灰水,若使澄清石灰水变浑浊,证明有NaHCO3,
故答案为:取少量产物于试管,加热,将产生的气体通入澄清石灰水,若使澄清石灰水变浑浊,证明有NaHCO3;
(5)①空气经过氢氧化钠的洗气瓶可将空气中的二氧化碳吸收,连接试样溶液可将装置中的产生的二氧化碳排出,所以(b)→(e)(f),从试样溶液中产生的二氧化碳混有水蒸气,所以需通过浓硫酸干燥二氧化碳,所以连接→(c)(d),最后通过碱石灰吸收产生的二氧化碳,所以连接→(g)(h)[或(h)(g)]→(i),
故答案为:(c)(d);(g)(h)[或(h)(g)]→(i);
②2NaHCO3
Na2CO3+H2O+CO2↑,w3-w1为碳酸氢钠分解生成的二氧化碳的质量,令产物中碳酸钠、碳酸氢钠的物质的量分别为xmol、ymol,根据二者质量之和与碳离子物质的量列方程,则:
,解得:x=
mol,产物中碳酸钠的质量分数为:
×100%或
×100%;
故答案为:
×100%或
×100%.
故答案为:过滤;
(2)因为氨气的溶解度比二氧化碳大得多,且溶液呈碱性,有利于二氧化碳的吸收;所以操作I先通入足量的氨气,操作II将二氧化碳通入氨化的饱和氯化钠溶液中,根据溶解度表可知,碳酸氢钠的溶解度比碳酸钠小,所以发生NH3+CO2+H2O═NH4HCO3;NH4HCO3+NaCl═NaHCO3↓+NH4Cl,本质为Na++NH3+CO2+H2O═NaHCO3↓+NH4+,
故答案为:Na++NH3+CO2+H2O═NaHCO3↓+NH4+;
(3)二氧化碳微溶于水,先通入二氧化碳,溶液中生成极少量的碳酸,再通入氨气,生成的产物量少,且易生成碳酸铵,氨气在水中溶解度很大,先通入氨气,溶液中生成较多的一水合氨,再通入CO2,生成的产物量多,且易生成碳酸氢铵,
故答案为:由于NH3在饱和NaCl溶液中溶解量比CO2大,先通NH3,溶液呈碱性,更易吸收CO2,有利NaHCO3的生成;所以应先通入NH3;
(4)碳酸氢钠受热易分解,如果碳酸钠中含有碳酸氢钠,取少量产物于试管,加热发生2NaHCO3
| ||
故答案为:取少量产物于试管,加热,将产生的气体通入澄清石灰水,若使澄清石灰水变浑浊,证明有NaHCO3;
(5)①空气经过氢氧化钠的洗气瓶可将空气中的二氧化碳吸收,连接试样溶液可将装置中的产生的二氧化碳排出,所以(b)→(e)(f),从试样溶液中产生的二氧化碳混有水蒸气,所以需通过浓硫酸干燥二氧化碳,所以连接→(c)(d),最后通过碱石灰吸收产生的二氧化碳,所以连接→(g)(h)[或(h)(g)]→(i),
故答案为:(c)(d);(g)(h)[或(h)(g)]→(i);
②2NaHCO3
| ||
|
| 44w-84w3+84w1 |
| 44×22 |
| 53(11W+21W1-21W3) |
| 121W |
| 106(11W+21W1-21W3) |
| 242W |
故答案为:
| 53(11W+21W1-21W3) |
| 121W |
| 106(11W+21W1-21W3) |
| 242W |
点评:本题以工业生产纯碱的工艺流程为背景,考查了物质的提纯、化学实验基本操作、实验结果的处理等知识,(5)装置连接、产物中碳酸钠的质量分数计算是解答本题的难点,题目难度中等.

练习册系列答案
相关题目
 某化学兴趣小组为了探究在常温下某非金属氧化物形成的未知气体的成分.该小组成员将气体通入澄清石灰水,发现变浑浊,持续通入发现浑浊又变澄清,由此该小组成员对气体的成分提出猜想.
某化学兴趣小组为了探究在常温下某非金属氧化物形成的未知气体的成分.该小组成员将气体通入澄清石灰水,发现变浑浊,持续通入发现浑浊又变澄清,由此该小组成员对气体的成分提出猜想.