题目内容
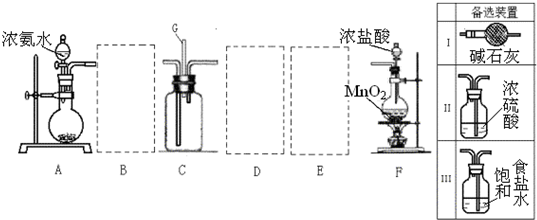
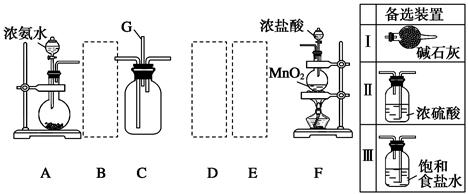
氯气和氨气在常温下混合即可发生反应.某兴趣小组同学为探究纯净、干燥的氯气与氨气的反应,设计了如图装置:
请回答:
(1)A装置中的试剂是
(2)写出装置F中发生反应的离子方程式是
(3)装置E中盛放的试剂是
(4)装置C中有白烟产生,试写出反应的化学方程式
(5)若从装置C的G处逸出的尾气中含有少量Cl2,为防止其污染环境,可将尾气通过盛有
分析:(1)A装置适合固体与固体加热制备气体据此选择制备氨气的试剂;常见仪器的名称;
(2)实验室用浓盐酸与二氧化锰反应制备氯气;依据反应方程式计算需要浓盐酸的体积;
(3)从F中制得的氯气含有氯化氢和水蒸气杂质,依次通过盛有饱和食盐水的E和盛有浓硫酸的D除去;
(4)氯气和氨气在C中发生氧化还原反应生成氮气和氯化氢,氯化氢与氨气反应生成氯化铵;
(5)用氢氧化钠溶液吸收过量的氯气.
(2)实验室用浓盐酸与二氧化锰反应制备氯气;依据反应方程式计算需要浓盐酸的体积;
(3)从F中制得的氯气含有氯化氢和水蒸气杂质,依次通过盛有饱和食盐水的E和盛有浓硫酸的D除去;
(4)氯气和氨气在C中发生氧化还原反应生成氮气和氯化氢,氯化氢与氨气反应生成氯化铵;
(5)用氢氧化钠溶液吸收过量的氯气.
解答:解:(1)根据A装置的特点可知装置A是用固体氯化铵和固体氢氧化钙加热制备氨气,所以A中试剂是氯化铵、氢氧化钙;根据仪器的图形可知B是干燥管;
(2)浓盐酸与二氧化锰在加热条件反应生成氯气和氯化锰和水,化学方程式为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,
离子方程式为:MnO2+4 H++2 Cl-
Mn2++Cl2↑+2 H2O;
560mL氯气的物质的量为n=
=0.025mol根据方程式得:
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
4 1
n(HCl) 0.025 解n(HCl)=0.1mol,V=
=0.0083L,即8.3ml,
故答案为:MnO2+4 H++2 Cl-
Mn2++Cl2↑+2 H2O; 8.3;
(3)从F中制得的氯气含有氯化氢和水蒸气杂质,通过盛有饱和食盐水的E可以除去氯化氢杂质,通过盛有浓硫酸的D可以除去水蒸气,
故答案为:饱和食盐水;除去氯气中的HCl气体;
(4)氯气和氨气发生氧化还原反应的方程式为:2NH3+3Cl2═N2+6HCl,氨气与氯化氢反应的方程式为:NH3+HCl═NH4Cl,
故答案为:2NH3+3Cl2═N2+6HCl NH3+HCl═NH4Cl;
(5)尾气中含有少量Cl2,为防止其污染环境,可以用盛有氢氧化钠溶液的洗气瓶吸收,反应的方程式是:
Cl2+2NaOH=NaCl+NaClO+H2O,
故答案为:氢氧化钠溶液.
(2)浓盐酸与二氧化锰在加热条件反应生成氯气和氯化锰和水,化学方程式为:MnO2+4HCl(浓)
| ||
离子方程式为:MnO2+4 H++2 Cl-
| ||
560mL氯气的物质的量为n=
| 0.56L |
| 22.4L/mol |
MnO2+4HCl(浓)
| ||
4 1
n(HCl) 0.025 解n(HCl)=0.1mol,V=
| 0.1mol |
| 12mol/L |
故答案为:MnO2+4 H++2 Cl-
| ||
(3)从F中制得的氯气含有氯化氢和水蒸气杂质,通过盛有饱和食盐水的E可以除去氯化氢杂质,通过盛有浓硫酸的D可以除去水蒸气,
故答案为:饱和食盐水;除去氯气中的HCl气体;
(4)氯气和氨气发生氧化还原反应的方程式为:2NH3+3Cl2═N2+6HCl,氨气与氯化氢反应的方程式为:NH3+HCl═NH4Cl,
故答案为:2NH3+3Cl2═N2+6HCl NH3+HCl═NH4Cl;
(5)尾气中含有少量Cl2,为防止其污染环境,可以用盛有氢氧化钠溶液的洗气瓶吸收,反应的方程式是:
Cl2+2NaOH=NaCl+NaClO+H2O,
故答案为:氢氧化钠溶液.
点评:本题考查氯气、氨气的制备和性质实验,题目难度中等,注意把握实验的原理和物质的化学性质.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目