题目内容
0.2mol某有机物和0.2mol O2在密闭容器中恰好完全反应,生成CO2、CO和H2O。将该混合气体依次通过浓硫酸、灼热的CuO和碱石灰后(假设每一步均充分反应),浓硫酸增重7.2g,CuO固体质量减少3.2g,而碱石灰增重17.6g。(
⑴产物的物质的量为:n(H2O)= mol,n(CO)= mol,n(CO2)= mol。
⑵该有机物的分子式为 。
⑶等量的该有机物分别与Na和NaHCO3反应,均产生气体,且在同温同压下生成的气体体积相同,则该有机物的结构简式为
⑴产物的物质的量为:n(H2O)= mol,n(CO)= mol,n(CO2)= mol。
⑵该有机物的分子式为 。
⑶等量的该有机物分别与Na和NaHCO3反应,均产生气体,且在同温同压下生成的气体体积相同,则该有机物的结构简式为
⑴ 0.4 ; 0.2 ; 0.2 ⑵ C2H4O3 ⑶ HO-CH2-COOH
考查有机物分子式。结构简式的判断及有关计算。浓硫酸增重7.2g,说明生成物水是7.2g,物质的量是0.4mol。根据方程式CO+CuO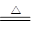 CO2+Cu可知,固体每减少16g,就消耗CO1mol,所以产生的CO是3.2÷16=0.2mol,同时生成CO20.2mol。碱石灰增加的质量包括燃烧产生的和CO还原氧化铜产生的,所以燃烧产生的CO2是17.6g÷44g/mol-0.2mol=0.2mol。因此有机物质氧原子的物质的量是0.4mol+0.2mol+0.2mol×2-0.2mol×2=0.6mol,所以根据原子守恒可知,有机物的分子式为C2H4O3。等量的该有机物分别与Na和NaHCO3反应,均产生气体,且在同温同压下生成的气体体积相同,说明含有1个羟基和1个羧基。,因此结构简式为HO-CH2-COOH。
CO2+Cu可知,固体每减少16g,就消耗CO1mol,所以产生的CO是3.2÷16=0.2mol,同时生成CO20.2mol。碱石灰增加的质量包括燃烧产生的和CO还原氧化铜产生的,所以燃烧产生的CO2是17.6g÷44g/mol-0.2mol=0.2mol。因此有机物质氧原子的物质的量是0.4mol+0.2mol+0.2mol×2-0.2mol×2=0.6mol,所以根据原子守恒可知,有机物的分子式为C2H4O3。等量的该有机物分别与Na和NaHCO3反应,均产生气体,且在同温同压下生成的气体体积相同,说明含有1个羟基和1个羧基。,因此结构简式为HO-CH2-COOH。
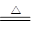 CO2+Cu可知,固体每减少16g,就消耗CO1mol,所以产生的CO是3.2÷16=0.2mol,同时生成CO20.2mol。碱石灰增加的质量包括燃烧产生的和CO还原氧化铜产生的,所以燃烧产生的CO2是17.6g÷44g/mol-0.2mol=0.2mol。因此有机物质氧原子的物质的量是0.4mol+0.2mol+0.2mol×2-0.2mol×2=0.6mol,所以根据原子守恒可知,有机物的分子式为C2H4O3。等量的该有机物分别与Na和NaHCO3反应,均产生气体,且在同温同压下生成的气体体积相同,说明含有1个羟基和1个羧基。,因此结构简式为HO-CH2-COOH。
CO2+Cu可知,固体每减少16g,就消耗CO1mol,所以产生的CO是3.2÷16=0.2mol,同时生成CO20.2mol。碱石灰增加的质量包括燃烧产生的和CO还原氧化铜产生的,所以燃烧产生的CO2是17.6g÷44g/mol-0.2mol=0.2mol。因此有机物质氧原子的物质的量是0.4mol+0.2mol+0.2mol×2-0.2mol×2=0.6mol,所以根据原子守恒可知,有机物的分子式为C2H4O3。等量的该有机物分别与Na和NaHCO3反应,均产生气体,且在同温同压下生成的气体体积相同,说明含有1个羟基和1个羧基。,因此结构简式为HO-CH2-COOH。
练习册系列答案
相关题目