题目内容
一种碳纳米管(氢气)二次电池原理如右下图。该电池的电解质为6mol/L KOH溶液,下列说法正确的是
| A.储存H2的碳纳米管放电时为负极,充电时为阳极 |
| B.充电时阳极反应为NiO(OH)+H2O+e﹣=Ni(OH)2+OH﹣ |
| C.放电时正极附近溶液的pH减小 |
| D.放电时负极反应为H2+2OH﹣﹣2e﹣=2H2O |
D
解析

练习册系列答案
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案
相关题目
下列叙述正确的是:
| A.石油和石蜡油都属于烃类,甘油、菜子油属于酯类 |
| B.“冰,水为之,而寒于水”说明相同质量的水和冰相比较,冰的能量高 |
| C.“春蚕到死丝方尽,蜡炬成灰泪始干”,这里的“丝”指蛋白质,“泪”指油脂 |
| D.原电池都是利用氧化还原反应进行的,两极可以是相同的金属 |
如右图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中。下列分析正确的是
| A.K1闭合,铁棒上发生的反应为2H++2e-→H2↑ |
| B.K1闭合,石墨棒周围溶液pH逐渐升高 |
| C.K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法 |
| D.K2闭合,电路中通过0.002NA个电子时,两极共产生0.001mol气体 |
结合如图装置判断,下列叙述正确的是
A.若X为NaCI,K与M相连时,石墨电极反应为 |
| B.若X为硫酸,K与M相连时,Fe作负极受到保护 |
| C.若X为硫酸,K与N相连时,溶液中H+向Fe电极移动 |
| D.若X为NaCI,K与N相连时,溶液中加入少量K3[Fe(CN)6],有蓝色沉淀生成 |
在下列装置中,MSO4和NSO4是两种常见金属的易溶盐。当K闭合时,SO42—从右到左通过交换膜移向M极,下列分析正确的是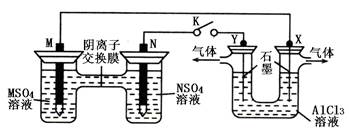
| A.溶液中c(M2+)减小 |
| B.N的电极反应式:N=N2++2e— |
| C.X电极上有H2产生,发生还原反应 |
| D.反应过程中Y电极周围生成白色胶状沉淀 |
如图是一种应用广泛的锂电池,LiPF6是电解质,SO(CH3)2是溶剂,反应原理是4Li+FeS2=Fe+2Li2S。下列说法正确的是
| A.该装置将电能转化为化学能 |
| B.Li+向a极移动 |
| C.可以用水代替SO(CH3)2做溶剂 |
| D.b极反应式是FeS2+4Li++4e-=Fe+2Li2S |
化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
| A.电解饱和食盐水时,阳极的电极反应式为:2Cl- +2e-=Cl2↑ |
| B.氢氧燃料电池的负极反应式:O2 + 2H2O+ 4e- ="=" 4OH- |
| C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu -2e- ="=" Cu2+ |
| D.钢铁发生电化学腐蚀的负极反应式:Fe-2e- ="=" Fe2+ |
分析下图所示的四个原电池装置,其中结论正确的是 ( )
| A.①②中Mg作负极,③④中Fe作负极 |
| B.②中Mg作正极,电极反应式为6H2O+6e-=6OH-+3H2↑ |
| C.③中Fe作负极,电极反应式为Fe-2e-=Fe2+ |
| D.④中Cu作正极,电极反应式为2H++2e-=H2↑ |
用惰性电极电解某金属元素R的硝酸盐R(NO3)n溶液,通电一段时间后,阳极产生气体V L(标准状况)时,阴极质量增加m g,若R的相对原子质量为M,设NA为阿伏加德罗常数的值,下列叙述中不正确的是
A.电路中通过电子 NA NA | B.n =  |
C.溶液中H+增加 NA NA | D.n = 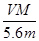 |