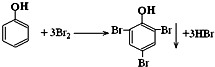
题目内容
3.混合物分离的方法在生产、生活和科学实验中有着广泛的应用.请指出下列做法中分别应用了哪些分离方法?(填代号)A、结晶 B、蒸发 C、过滤 D、渗析 E、萃取 F、蒸馏 G、分液
(1)从溴水中提取溴E (2)分离豆浆和豆渣C
(3)分离NaCl和KNO3A (4)从鸡蛋清中除去少量的NaCl杂质D
(5)分离汽油和水G 99(6)分离乙醇和水F.
分析 (1)溴易溶于有机溶剂;
(2)豆渣不能透过滤纸;
(3)NaCl和KNO3的溶解度随温度变化不同;
(4)鸡蛋白不能透过半透膜;
(5)汽油和水互不相溶;
(6)乙醇和水的沸点不同,可蒸馏分离.
解答 解:(1)溴易溶于有机溶剂,可用萃取的方法分离,故答案为:E;
(2)豆渣不能透过滤纸,可用过滤的方法分离,故答案为:C;
(3)NaCl和KNO3的溶解度随温度变化不同,可用结晶的方法分离,故答案为:A;
(4)鸡蛋白不能透过半透膜,可用渗析的方法分离,故答案为:D;
(5)汽油和水互不相溶,可用分液的方法分离,故答案为:G;
(6)乙醇和水的沸点不同,可在混合物中加入生石灰,然后用蒸馏分离,故答案为:F.
点评 本题考查混合物分离提纯方法的选择和应用,为高频考点,把握物质的性质及性质差异选择分离方法为解答的关键,侧重混合物分离物理方法及实验基本技能的考查,题目难度不大.

练习册系列答案
相关题目
13.下列反应既是离子反应,又是氧化还原反应的是( )
| A. | 氯化钠溶液中滴入硝酸银溶液 | |
| B. | 氢气还原氧化铜 | |
| C. | 铁片置于硫酸铜溶液中 | |
| D. | 用氢氧化钠溶液溶解带氧化膜的铝片 |
11.设NA为阿伏伽德罗常数,下列说法正确的是( )
| A. | 0.2mol/L的AlCl3溶液中,阳离子总数大于0.2NA | |
| B. | 工业制取漂白粉时,理论上每制得25.4g产品,反应中转移电子数为0.2NA | |
| C. | 30g甲酸甲酯与30g葡萄糖中含C-H键个数均为2NA | |
| D. | 将2.7g铝粉投入足量的热的浓硝酸中充分反应,可收集到标况下气体6.72 L |
18.下列推断正确的是( )
| A. | CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 | |
| B. | SiO2 是酸性氧化物,能与NaOH溶液反应 | |
| C. | Na2O、Na2O2组成元素相同,与 CO2反应产物也相同 | |
| D. | SO2和新制氯水均有漂白性,将SO2和Cl2通入滴加少量紫色石蕊试液,充分振荡后溶液最终呈无色 |
8.下列有关热化学反应的说法中正确的是( )
| A. | 放热反应比吸热反应更容易发生 | |
| B. | 凡是在加热或点燃条件下进行的反应都是吸热反应 | |
| C. | 向1L 1 mol/L NaOH溶液中加入一定量浓H2SO4溶液至恰好反应完全时,共放出65 kJ的热量.则表示该反应的中和热的热化学方程式为:$\frac{1}{2}$H2SO4(aq)+NaOH(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-65kJ•mol-1 | |
| D. | 已知:2CO(g)+O2(g)═2CO2(g)△H=-566 kJ•mol-1,由此可知CO的燃烧热为283 kJ•mol-1 |
15.为扩大现有资源的使用效率,在一些油品中加入了降凝制剂J,以降低油料的凝固点,扩大燃料油的使用范围.J是一种高分子化合物: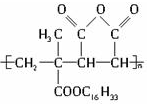 下列有关J的说法正确的是( )
下列有关J的说法正确的是( )
 下列有关J的说法正确的是( )
下列有关J的说法正确的是( )| A. | J是由2种单体缩聚而成的 | B. | J是由2种单体加聚而成的 | ||
| C. | J具有可燃性 | D. | J没有可燃性 |
12.下列分子中,所有原子的最外层均为8电子结构的是( )
| A. | PCl3 | B. | H2S | C. | BeCl2 | D. | SF6 |
13.下表是四个反应的有关信息:
下列结论正确的是( )
| 序号 | 氧化剂 | 还原剂 | 其它反应物 | 氧化产物 | 还原产物 |
| ① | Cl2 | FeBr2 | FeCl3 | ||
| ② | KMnO4 | H2O2 | H2SO4 | O2 | MnSO4 |
| ③ | KClO3 | HCl(浓) | Cl2 | Cl2 | |
| ④ | KMnO4 | HCl(浓) | Cl2 | MnCl2 |
| A. | 第①组反应的氧化产物一定只有FeCl3(实为Fe3+) | |
| B. | 第③组反应的产物还有KCl和H2O | |
| C. | 氧化性比较:KMnO4>Cl2>Fe3+>Br2>Fe2+ | |
| D. | 还原性比较:H2O2>Mn2+>Cl- |