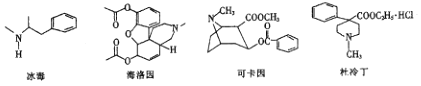
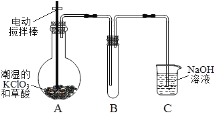
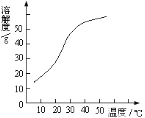
题目内容
【题目】在分析化学中,NH3或其水溶液是一种常用的沉淀剂,用于物质的分离和提纯。已知:NH3H2O的电离常数K=1.8×10-5,K sp[Mg(OH)2]=1.8×10-11。向体积为1.0 L、浓度为2.0×10-4 mol·L-1的MgCl2溶液中通入NH3,若不考虑溶液体积变化,当反应开始有白色沉淀出现时,通入NH3的体积(标准状况)为( )
A.112mL B.224mL C.118.72 mL D.201.6 mL
【答案】C
【解析】
试题分析:当反应开始有白色沉淀时,c(Mg2+)×c(OH-)2= K sp[Mg(OH)2]=1.8×10-11,c(OH-)2 = 1.8 × 10-11 ÷ 2.0 × 10-4 = 9 × 10-8 ,c(OH-) = 3 × 10-4mol/L,根据NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4++OH-,[c(NH3·H2O)-0.0003]= 9×10-8÷1.8×10-5=0.005mol/L,则c(NH3·H2O)=0.0053mol/L,所以氨气的物质的量为0.0053mol,在标准状况下的体积为0.0053mol×22.4L/mol=0.11872L=118.72mL,答案选C。
NH4++OH-,[c(NH3·H2O)-0.0003]= 9×10-8÷1.8×10-5=0.005mol/L,则c(NH3·H2O)=0.0053mol/L,所以氨气的物质的量为0.0053mol,在标准状况下的体积为0.0053mol×22.4L/mol=0.11872L=118.72mL,答案选C。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目