题目内容
【题目】Cu2O是重要的催化剂和化工原料,工业上制备Cu2O的主要反应如下:
①C(s)+CO2(g)2CO(g) ΔH=+172.5 kJ·mol-1
②CO(g)+2CuO(s) Cu2O(s)+CO2(g) ΔH=-138.0 kJ·mol-1
(1)C与CuO反应生成Cu2O和CO的热化学方程式为_______。
(2)一定温度下,向5L恒容密闭容器中加入1molCO和2 molCuO,发生反应②,5 min时达到平衡,测得容器中CuO的物质的量为0.8mol。
①0~5 min内,用CO2表示的反应速率v(CO2)=____。
②CO的平衡转化率α=_______。
(3)向5L密闭容器中加入1molC和1molCO2,发生反应①,CO2、CO的平衡体积分数(φ)与温度(T)的关系如图所示:
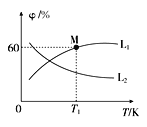
①能表示CO2的平衡体积分数与温度关系的曲线为____(填“L1”或“L2”),理由为_______。
②温度为T1时,该反应的平衡常数K=_____。
【答案】C(s)+2CuO(s)Cu2O(s)+CO(g) ΔH=+34.5 kJ·mol-1 0.024 mol·L-1·min-1 60% L2 该反应为吸热反应,温度升高,平衡正移,CO2的平衡体积分数减小 ![]()
【解析】
(1)①C(g)+CO2(g)2CO(g) ΔH=+172.5kJ/mol
②CO(g)+2CuO(s)Cu2O(s)+CO2(g) ΔH=-138.0KJ/mol
结合盖斯定律计算,①+②得到C与CuO反应生成Cu2O和CO的热化学方程式;
(2)①.依据反应三段式计算列式计算消耗量,反应速率v=![]() ;
;
②.转化率=![]() ×100%;
×100%;
(3)①.向5L密闭容器中加入1molC和1molCO2,发生反应①为C(g)+CO2(g)2CO(g) ΔH =+172.5kJ/mol,反应为吸热反应,二氧化碳平衡体积分数(φ)随温度升高减小;
②.温度为T1时,结合化学三段式计算列式计算平衡浓度,该反应的平衡常数K= ![]() 。
。
(1)结合盖斯定律计算,①+②得到C(s)+2CuO(s)Cu2O(s)+CO(g) ΔH=+34.5 kJ·mol-1,
故答案为:C(s)+2CuO(s)Cu2O(s)+CO(g) ΔH=+34.5 kJ·mol-1;
(2)①.一定温度下,向5L恒容密闭容器中加入1molCO和2molCuO,发生反应②,5min时达到平衡,测得容器中CuO的物质的量为0.8mol,
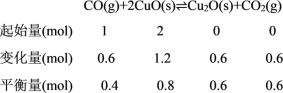
05min内,用CO2表示的反应速率v(CO2)= =0.024molL1min1,
=0.024molL1min1,
故答案为:0.024molL1min1;
②.CO的平衡转化率α=![]() ×100%=60%,
×100%=60%,
故答案为:60%;
(3)①.向5L密闭容器中加入1molC和1molCO2,发生反应①为C(g)+CO2(g)2CO(g) ΔH =+172.5kJ/mol,反应为吸热反应,温度升高,平衡正移,二氧化碳平衡体积分数(φ)随温度升高减小,所以能表示CO2的平衡体积分数与温度关系的曲线为L2,
故答案为:L2;该反应为吸热反应,温度升高,平衡正移,CO2的平衡体积分数减小;
②.温度为T1时,CO体积分数为60%,设碳消耗物质的量浓度x,
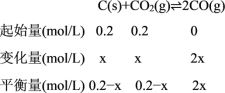
![]() =60%,x=
=60%,x=![]() ,
,
K=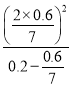 =
=![]() ,
,
故答案为:![]() 。
。

 精英口算卡系列答案
精英口算卡系列答案