题目内容
【题目】在一个容积固定为2L的密闭容器中,发生反应:aA(g)+bB(g)pC(g)△H=?,反应情况记录如表:
时间(min) | n(A)(mol) | n(B)(mol) | n(C)(mol) |
0 | 1 | 3 | 0 |
第2min | 0.8 | 2.6 | 0.4 |
第4min | 0.4 | 1.8 | 1.2 |
第6min | 0.4 | 1.8 | 1.2 |
第8min | 0.1 | 2.0 | 1.8 |
第9min | 0.05 | 1.9 | 0.3 |
请根据表中数据仔细分析,回答下列问题:
(1)第2min到第4min内A的平均反应速率v(A)=molL﹣1min﹣1
(2)由表中数据可知反应在第4min到第6min时处于平衡状态,若在第2min、6min时分别改变了某一个反应条件,则改变的条件分别可能是:①第 2min;②第 6min;
(3)反应在第4min建立平衡,此温度下该反应的化学平衡常数 K= .
(4)判断第9min时(是/否)达平衡,说明理由 .
【答案】
(1)0.1
(2)使用催化剂、升高温度;增加B的浓度
(3)2.22
(4)否;因为Qc<K
【解析】解:在前2min内,各物质的浓度的变化量之比(1﹣0.8):(3﹣2.6):(0.4﹣0)=1:2:2,则方程式为A (g)+2B(g)2C(g).
(1.)第2min到第4min内A物质的化学反应速率v(A)= ![]() =
= ![]() =0.1mol/(lmin),所以答案是:0.1;
=0.1mol/(lmin),所以答案是:0.1;
(2.)①在第0~2min内,A的物质的量减小了0.2mol,在2~4min内A的物质的量在原基础上减小了0.4mol,化学反应速率加快了,可以是使用催化剂或升高温度,所以答案是:使用催化剂、升高温度;
②第6min 到第8min,作为反应物,浓度应该是减小的趋势,但是B的物质的量从1.8mol增加到了2.0mol,而A在减小,C在增大,所以可知一定是加入了B物质
所以答案是:增加B的浓度;
(3.)反应在第4min建立平衡,c(A)= ![]() =0.2mol/L,c(B)=
=0.2mol/L,c(B)= ![]() =0.9mol/L,c(C)=
=0.9mol/L,c(C)= ![]() =0.6mol/L,则K=
=0.6mol/L,则K= ![]() =
= ![]() =2.22;
=2.22;
所以答案是:2.22;
(4.)Qc= ![]() =
= 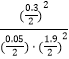 =0.997<K=2.22,则反应未达到平衡状态;所以答案是:否,因为Qc<K.
=0.997<K=2.22,则反应未达到平衡状态;所以答案是:否,因为Qc<K.
【考点精析】根据题目的已知条件,利用化学平衡状态本质及特征和化学平衡的计算的相关知识可以得到问题的答案,需要掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效);反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.