题目内容
【题目】“西气东输”的气体是指天然气,主要成分是甲烷.工业上用碳与水在高温下反应制得水煤气.水煤气的主要成分是CO和H2 , 两者体积比约为1:1.1mol CO气体完全燃烧生成CO2气体放出283kJ热量,1molH2完全燃烧生成气态水放出242kJ热量;1molCH4气体完全燃烧生成CO2气体和气态水放出802kJ热量.
(1)写出H2完全燃烧生成气态水的热化学反应方程式:;
(2)忽略水煤气中其它成分,相同状况下若产生相等的热量,则所需水煤气体积是甲烷体积的倍,水煤气放出CO2的体积是甲烷放出CO2的体积的倍.
(3)以天然气代替水煤气作民用燃料,突出的优点是和 . (任写2点)
【答案】
(1)H2(g)+ ![]() O2(g)=H2O(g)△H=﹣242kJ/mol
O2(g)=H2O(g)△H=﹣242kJ/mol
(2)3.06;1.5
(3)热值高;污染小产生温室气体少
【解析】解:(1)1mol H2完全燃烧生成气态水放出242kJ热量,所以H2完全燃烧生成气态水的热化学方程式:H2(g)+ ![]() O2(g)=H2O(g)△H=﹣242kJmol﹣1 ,
O2(g)=H2O(g)△H=﹣242kJmol﹣1 ,
所以答案是:H2(g)+ ![]() O2(g)=H2O(g)△H=﹣242kJ/mol;
O2(g)=H2O(g)△H=﹣242kJ/mol;
(2.)依据热化学方程式:H2(g)+ ![]() O2(g)=H2O(l)△H=﹣242kJmol﹣1;
O2(g)=H2O(l)△H=﹣242kJmol﹣1;
CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=﹣802kJ/mol;
CO(g)+ ![]() O2(g)=CO2(g)△H=﹣283KJ/mol;
O2(g)=CO2(g)△H=﹣283KJ/mol;
水煤气中主要成分是CO和H2 , 二者的体积比为l:l,1molCH4燃烧放热802kJ,1molCO、H2混合气体放热 ![]() kJ=262.5kJ,相同状况下若得到相等的热量,所需水煤气与甲烷的体积比约为
kJ=262.5kJ,相同状况下若得到相等的热量,所需水煤气与甲烷的体积比约为 ![]() :
: ![]() =3.06:1,所需水煤气体积是甲烷体积的3.06倍,燃烧生成的CO2的体积比等于其物质的量之比=
=3.06:1,所需水煤气体积是甲烷体积的3.06倍,燃烧生成的CO2的体积比等于其物质的量之比= ![]() =1.5:1,水煤气放出CO2的体积是甲烷放出CO2的体积的1.5倍,
=1.5:1,水煤气放出CO2的体积是甲烷放出CO2的体积的1.5倍,
所以答案是:3.06,1.5;
(3.)以上数据和计算说明,相同物质的量的天然气和水煤气,天然气燃烧放出的热量多,即热值高,燃烧产生的温室气体CO2少,
所以答案是:热值高,污染小产生温室气体少.

 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案【题目】某化学兴趣小组欲对含少量硫酸亚铁和硫酸铁的硫酸铜溶液进行综合实验:
(1)除去Fe2+和Fe3+并制备CuSO45H2O,请根据以下流程回答问题: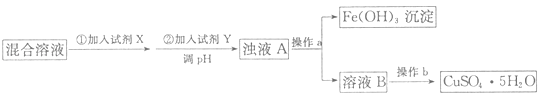
有关氢氧化物开始沉淀和沉淀完全的pH如下表:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀的pH | 1.9 | 6.5 | 4.7 |
沉淀完全的pH | 3.7 | 9.7 | 6.7 |
①试剂X的化学式为 , 加入试剂Y调节溶液pH的范围是;
②操作a用到的玻璃仪器为烧杯,玻璃棒和;操作b的名称为;
(2)已知:5Fe2++MnO4﹣+8H+=5Fe3++Mn2++4H2O,欲测定混合溶液中的Fe2+的浓度,取待测液20.00mL,用浓度为0.01molL﹣1的酸性KMnO4溶液滴定,下列滴定方式中,最合理的是(填字母序号,夹持部分已略去)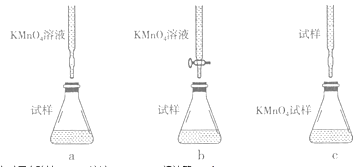
达到终点时用去酸性KMnO4溶液12.00mL,请计算c(Fe2+)= .
【题目】在一个容积固定为2L的密闭容器中,发生反应:aA(g)+bB(g)pC(g)△H=?,反应情况记录如表:
时间(min) | n(A)(mol) | n(B)(mol) | n(C)(mol) |
0 | 1 | 3 | 0 |
第2min | 0.8 | 2.6 | 0.4 |
第4min | 0.4 | 1.8 | 1.2 |
第6min | 0.4 | 1.8 | 1.2 |
第8min | 0.1 | 2.0 | 1.8 |
第9min | 0.05 | 1.9 | 0.3 |
请根据表中数据仔细分析,回答下列问题:
(1)第2min到第4min内A的平均反应速率v(A)=molL﹣1min﹣1
(2)由表中数据可知反应在第4min到第6min时处于平衡状态,若在第2min、6min时分别改变了某一个反应条件,则改变的条件分别可能是:①第 2min;②第 6min;
(3)反应在第4min建立平衡,此温度下该反应的化学平衡常数 K= .
(4)判断第9min时(是/否)达平衡,说明理由 .