题目内容
Ⅰ. (2010·黄山质检)下表中的数据是破坏1 mol物质中的化学键所消耗的能量(kJ)。
| 物质 | F2 | Cl2 | Br2 | I2 | H2 | HF | HCl | HBr | HI |
| 能量(kJ) | 157 | 243 | 194 | 153 | 436 | 568 | 432 | 366 | 299 |
(1)下列物质本身具有的能量最低的是( )
A.H2 B.Cl2 C.Br2 D.I2
(2)下列氢化物中,最稳定的是( )
A.HF B.HCl C.HBr D.HI
(3)X2+H2===2HX(X代表F、Cl、Br、I)的反应是吸热反应还是放热反应?答:____________。
(4)相同条件下,X2(X代表F、Cl、Br、I)分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的热量最多的是__________。
(5)若无上表中的数据,你能正确回答出问题(4)吗?
答:________。你的根据是___________________ _。
Ⅱ.下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。

(1) B元素位于________区,F元素位于________区。
(2) A、B二种元素的原子按4∶2形成的分子中含______个σ键,______个π键,B元素的原子轨道发生的是________杂化。
(15分)Ⅰ. (1)A (2)A (3)放热反应 (4)F2
(5)能 生成物越稳定,其能量越低,反应放热就越多,在HX中,HF最稳定
Ⅱ.(1)p d (2)5 1 sp2
(5)能 生成物越稳定,其能量越低,反应放热就越多,在HX中,HF最稳定
Ⅱ.(1)p d (2)5 1 sp2
试题分析:Ⅰ. (1)原子结合形成单质分子时,放出的能量越多,分子越稳定,所以根据键能数据可知,氢气是最稳定的,答案选A。
(2)同样形成HX分子时,放出的能量越多,分子越稳定,所以根据键能数据可知,HF是最稳定的,答案选A。
(3)反应热就是断键吸收的能量和形成化学键所放出的能量的差值,则根据有关的键能数据可知,X2+H2===2HX(X代表F、Cl、Br、I)的反应都是放热反应。
(4)单质氟中键能最小,而HF中键能最大,所以氢气和单质氟反应放出的热量最多。
(5)由于生成物越稳定,其能量越低,反应放热就越多,而在在HX中,HF最稳定,所以不需要键能也能得出正确的的结论。
Ⅱ.(1)区的名称来自于按照构造原理最后填入电子的轨道名称,所以根据元素在周期表中的位置可知,B是碳元素,位于p区。F是Ni,位于d区。
(2)A和B是H和C,二种元素的原子按4∶2形成的分子是乙烯。乙烯分子中含有碳碳双键,而单键都是σ键,双键是由1个σ键和1个π键构成的,所以乙烯分子中含有5个σ键,1个π键。乙烯是平面型结构,碳原子是sp2杂化。
点评:该题是中等难度的试题,试题基础性强,难易适中,贴近高考。在注重对基础知识巩固与训练的同时,侧重对学生能力的培养和解题方法与技巧的指导和训练。有利于培养学生的逻辑推理和抽象思维能力,提高学生的应试能力和学习效率。

练习册系列答案
相关题目

 2CO(g);
2CO(g);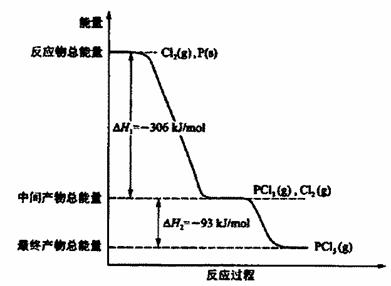
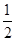 O2(g)===H2O(l);ΔH=-285.8 kJ·mol-1 ,则H2的燃烧热为-285.8 kJ·mol-1
O2(g)===H2O(l);ΔH=-285.8 kJ·mol-1 ,则H2的燃烧热为-285.8 kJ·mol-1