题目内容
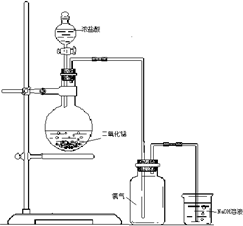 如图是一位同学设计的实验室制取氯气的实验装置图.
如图是一位同学设计的实验室制取氯气的实验装置图.(1)指出这套装置中存在的错误
(2)烧杯里装有氢氧化钠溶液,其作用是
(3)把Cl2通入NaBr溶液中,并向其中加入少量四氯化碳,振荡后静置,液体分为两层,上层为
分析:(1)该反应需要加热条件下发生,且氯气与NaOH溶液发生反应,会倒吸;
(2)氯气有毒,不能排放在空气中,与碱反应转化为无毒物质;
(3)Cl2通入NaBr溶液中,生成单质溴,并向其中加入少量四氯化碳,发生萃取.
(2)氯气有毒,不能排放在空气中,与碱反应转化为无毒物质;
(3)Cl2通入NaBr溶液中,生成单质溴,并向其中加入少量四氯化碳,发生萃取.
解答:解:(1)该反应需要加热条件下发生,且氯气与NaOH溶液发生反应,会倒吸,则图中错误为缺少酒精灯、尾气处理的导管不能深入液面以下(或应利用倒扣的漏斗),故答案为:缺少酒精灯;尾气处理的导管不能深入液面以下;
(2)氯气有毒,不能排放在空气中,则烧杯里装有氢氧化钠溶液,其作用是吸收尾气,防止污染环境,发生的反应为Cl2+2NaOH=NaClO+NaCl+H2O,
故答案为:吸收尾气,防止污染环境;Cl2+2NaOH=NaClO+NaCl+H2O;
(3)Cl2通入NaBr溶液中,生成单质溴,并向其中加入少量四氯化碳,溴易溶于四氯化碳,分层后上层为无色,下层为橙黄色,故答案为:无;橙黄.
(2)氯气有毒,不能排放在空气中,则烧杯里装有氢氧化钠溶液,其作用是吸收尾气,防止污染环境,发生的反应为Cl2+2NaOH=NaClO+NaCl+H2O,
故答案为:吸收尾气,防止污染环境;Cl2+2NaOH=NaClO+NaCl+H2O;
(3)Cl2通入NaBr溶液中,生成单质溴,并向其中加入少量四氯化碳,溴易溶于四氯化碳,分层后上层为无色,下层为橙黄色,故答案为:无;橙黄.
点评:本题考查实验室制氯气的原理和氯气的性质,把握实验原理和物质的性质为解答的关键,注意浓盐酸和二氧化锰能反应,但稀盐酸和二氧化锰不反应,且反应需要加热,明确尾气处理及萃取中Br2的CCl4或苯溶液为橙黄色即可解答,题目难度不大.

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案
相关题目
(10分)氯气是氯碱工业的主要产品之一,它是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:
Cl2 + H2O  HCl + HClO K=4.5×10-4
HCl + HClO K=4.5×10-4
次氯酸的强氧化性能杀死水中的病菌(不直接用次氯酸为自来水消毒是因为次氯酸易分解,且毒性较大)。但是,由于氯气贮运不方便,且具有一定的危险性,目前正逐渐被其它性能优越的消毒产品所替代。请回答:
(1)氯碱工业生产氯气的化学方程式为 。
(2)84消毒液(主要成分为NaClO)与氯气相比具有贮运方便等优点,用氯气与烧碱溶液反应制备84消毒液的离子方程式为 。
(3)二氧化氯是一种高效、广谱、安全的杀菌、保鲜剂。我国科学家研发了用氯气氧化亚氯酸钠(NaClO2)固体制备二氧化氯的方法,其化学方程式为 。
(4)一位同学设计了一套用浓盐酸和KMnO4固体制取少量氯气并比较氯气与碘单质的氧
化性强弱的微型装置(如图)。
①下列溶液能吸收Cl2的是 (填字母序号)。
| A.饱和食盐水 | B.饱和Na2SO3溶液 |
| C.饱和NaOH溶液 | D.浓硫酸 |
 氯气是氯碱工业的主要产品之一,是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸:
氯气是氯碱工业的主要产品之一,是一种常用的消毒剂,其消毒原理是与水反应生成了次氯酸: