题目内容
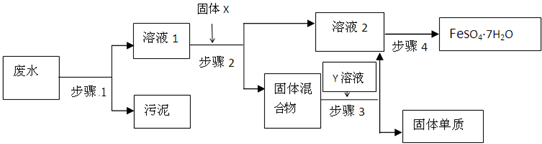
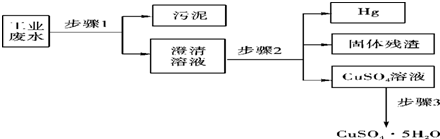
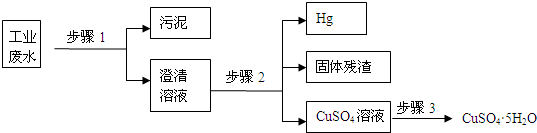
已知某工业废水中含有大量FeSO4,较多的Cu2+,少量的Na+以及部分污泥,通过下列流程可从该废水中回收FeSO4?7H2O晶体及金属Cu.

(1)步骤1、步骤2、步骤3的主要操作是______相同”或“不相同”),需用到的玻璃仪器除烧杯外还有______.
(2)步骤2中发生反应的离子方程式为______;
(3)步骤3中发生反应的化学方程式为______;
(4)步骤4中涉及的操作是:蒸发浓缩.______.过滤.洗涤.烘干.
(5)最后的固体单质是______(填名称).
解:(1)步骤1、步骤2、步骤3都为过滤操作,需要的玻璃仪器有烧杯、玻璃棒、普通漏斗,故答案为:相同;普通漏斗、玻璃棒;
(2)在步骤2中加入过量的Fe,发生Fe+Cu2+═Cu+2Fe2+,以制得单质Cu,故答案为:Fe+Cu2+═Cu+2Fe2+;
(3)经步骤2后所得固体混合物为Fe和Cu的混合物,过量的Fe用稀硫酸除去,发生反应为Fe+H2SO4═FeSO4+H2↑,故答案为:Fe+H2SO4═FeSO4+H2↑;
(4)最后所得滤液经蒸发浓缩、冷却结晶、过滤可得到FeSO4?7H2O晶体,故答案为:冷却结晶;
(5)Cu与稀硫酸不反应,最后所得固体为铜,故答案为:铜.
分析:工业废水中含有大量FeSO4,较多的Cu2+,少量的Na+以及部分污泥,首先通过步骤1进行过滤除去污泥,在步骤2中加入过量的Fe,发生Fe+Cu2+═Cu+2Fe2+,过量的Fe用稀硫酸除去,发生反应为Fe+H2SO4═FeSO4+H2↑,最后所得滤液经蒸发浓缩、冷却结晶、过滤可得到FeSO4?7H2O晶体.
点评:本题考查物质的分离和提纯,题目难度不大,注意根据物质的性质选择分离提纯的方法,特别是过滤和蒸发结晶操作,注意把握所使用仪器和操作步骤.
(2)在步骤2中加入过量的Fe,发生Fe+Cu2+═Cu+2Fe2+,以制得单质Cu,故答案为:Fe+Cu2+═Cu+2Fe2+;
(3)经步骤2后所得固体混合物为Fe和Cu的混合物,过量的Fe用稀硫酸除去,发生反应为Fe+H2SO4═FeSO4+H2↑,故答案为:Fe+H2SO4═FeSO4+H2↑;
(4)最后所得滤液经蒸发浓缩、冷却结晶、过滤可得到FeSO4?7H2O晶体,故答案为:冷却结晶;
(5)Cu与稀硫酸不反应,最后所得固体为铜,故答案为:铜.
分析:工业废水中含有大量FeSO4,较多的Cu2+,少量的Na+以及部分污泥,首先通过步骤1进行过滤除去污泥,在步骤2中加入过量的Fe,发生Fe+Cu2+═Cu+2Fe2+,过量的Fe用稀硫酸除去,发生反应为Fe+H2SO4═FeSO4+H2↑,最后所得滤液经蒸发浓缩、冷却结晶、过滤可得到FeSO4?7H2O晶体.
点评:本题考查物质的分离和提纯,题目难度不大,注意根据物质的性质选择分离提纯的方法,特别是过滤和蒸发结晶操作,注意把握所使用仪器和操作步骤.

练习册系列答案
相关题目

 已知某工业废水中含有N
已知某工业废水中含有N