题目内容
【题目】氨与硝酸都是氮的重要化合物,在工农业生产中有广泛应用。回答下列问题。
(1)氨气的制备
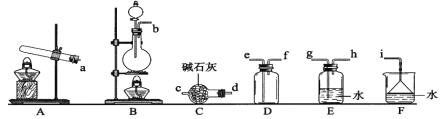

①氨气制取的发生装置可以选择上图中的_________(填字母),反应的化学方程式为__________。
②选择上图装置组装一套实验装置来收集一瓶干燥的氨气,所选装置的连接顺序为:发生装置→______→______,______→_____→i(按气流方向,用小写英文字母表示)。
③可用如右装置进行氨的喷泉实验,引发喷泉的操作是__________。
(2)如图所示,NH3经一系列反应可以得到HNO3。

①反应①的化学方程式为__________________________。
②产物NO是大气污染物之一。在400℃左右且有催化剂存在的情况下,可用氨将一氧化氮还原为无色无毒气体。该反应的化学方程式_______________________。
【答案】A Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O d c f e 先挤压胶头滴管的水进入圆底烧瓶,再打开止水夹 4NH3+5O2
CaCl2+2NH3↑+2H2O d c f e 先挤压胶头滴管的水进入圆底烧瓶,再打开止水夹 4NH3+5O2![]() 4NO+6H2O 4NH3+6NO
4NO+6H2O 4NH3+6NO![]() 5N2+6H2O
5N2+6H2O
【解析】
(1) ①在实验室中是用铵盐与碱共热制取氨气的,反应的化学方程式为Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O;反应物都是固体,反应需要在加热条件下进行,为防止产生的水回流,使试管炸裂,所以要选择A装置制取氨气;
CaCl2+2NH3↑+2H2O;反应物都是固体,反应需要在加热条件下进行,为防止产生的水回流,使试管炸裂,所以要选择A装置制取氨气;
②选用A装置制取氨气;然后用C装置干燥氨气;然后选用D装置用向下排空气的方法收集氨气,为防止氨气污染空气,同时要注意防止倒吸现象的发生,最后用F进行尾气处理,按气流方向,用小写英文字母表示连接顺序为a→d→c→f→e→i;
③可用如右装置进行氨的喷泉实验,引发喷泉的操作是先挤压胶头滴管,使其中的水进入圆底烧瓶,然后打开止水夹,烧瓶内氨气溶解在水中,气体压强减小,烧杯内的水在大气压强作用下不断进入烧瓶内,从而形成喷泉;
(2) ①NH3与氧气在催化剂存在时,在加热条件,被氧化产生NO,同时有水生成,反应的化学方程式为4NH3+5O2![]() 4NO+6H2O;
4NO+6H2O;
②在400℃左右且有催化剂存在的情况下,可用氨将一氧化氮还原为无色无毒气体是N2和CO2,根据电子守恒、原子守恒。可得该反应的化学方程式:4NH3+6NO![]() 5N2+6H2O。
5N2+6H2O。

【题目】实验室用下图所示装置制备氯气并进行一系列相关实验(夹持设备及必要的加热装置已省略)。

(1)整套装置装配完毕后,首先进行的操作是______________________,再添加试剂。
(2)实验室常用MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O制取氯气:
MnCl2+Cl2↑+2H2O制取氯气:
①实验时,通常采用密度为1.19g/cm3、浓度为36.5%的浓盐酸。该浓盐酸的物质的量浓度为___________________________。
②标准状况下,上述反应每生成4.48L氯气,转移电子的物质的量为_________ mol。
(3)洗气装置B的作用是除去Cl2中的HCl气体,同时用作安全瓶(监测实验时装置C中是否发生堵塞)。若装置C发生堵塞,装置B中将观察到的现象是_____________。
(4)装置C的作用是验证氯气是否具有漂白性。为此,实验时装置C中I、II、III处依次放入的物质是___________(填字母)。
A | B | C | D | |
I | 干燥的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 湿润的有色布条 |
II | 碱石灰 | 无水氯化钙 | 无水氯化钙 | 浓硫酸 |
III | 湿润的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 干燥的有色布条 |
(5)设计装置D、E的目的是比较氯、溴、碘的氧化性。当向D中缓缓通入一定量氯气时,可以看到无色溶液逐渐变为橙色,说明氯气的氧化性比溴单质的______(填“强”“或“弱”)。打开活塞,将装置D中少量溶液加入装置E中,振荡后静置,观察到的现象是___________。
(6)F为尾气吸收装置。实验时,该装置中反应的离子方程式______________。


