题目内容
【题目】C、N、S的氧化物常会造成一些环境问题,科研工作者正在研究用各种化学方法来消除这些物质对环境的影响。
(1)CO2的重整:用CO2和H2为原料可得到CH4燃料。
已知:
CH4( g) +CO2( g) ![]() 2CO( g)+2H2( g) △H1=+247kJ·mol-1
2CO( g)+2H2( g) △H1=+247kJ·mol-1
CH4(g) +H2O(g) ![]() CO( g)+3H2(g) △H2=+205kJ mol-1
CO( g)+3H2(g) △H2=+205kJ mol-1
写出CO2重整的热化学方程式_________________。
(2)“亚硫酸盐法”吸收烟气中的SO2。
①将烟气通入1.0mol·L-1的Na2SO3溶液,若此过程中溶液体积不变,则溶液的pH不断___________。(填“减小”、“ 不变”或 “增大”)。当溶液pH约为6时,吸收SO2的能力显著下降,应更换吸收剂,此时溶液中c(SO32-)=0.2mol ·L-1,则溶液中c(HSO3-)=____________。
②室温条件下,将烟气通入(NH4)2SO3溶液中,测得溶液pH与各组分物质的量分数的变化关系如图甲所示。
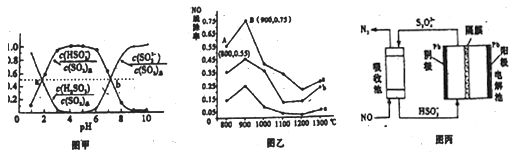
a点时n(HSO3-):n(H2SO3)=__________,b点时溶液pH=7,则n(NH4+):n(HSO3-)=___________。
(3)催化氧化法去除NO,—定条知下,用NH3消除NO污染,其反应原理为4NH3+6NO![]() 5N2+6H2O。不同温度条件下,n(NH3):n(NO)的物质的量之比分別为4:1、3:3、1:3时,得到NO脱除率曲线如图乙所示:
5N2+6H2O。不同温度条件下,n(NH3):n(NO)的物质的量之比分別为4:1、3:3、1:3时,得到NO脱除率曲线如图乙所示:
①曲线a中NO的起始浓度为6×10-4 mg/m3,从A点到B点经过0.8s,该时间段内NO的脱除速率
为__________mg/(m3·s)
②曲线b对应NH3与NO的物质的量之比是__________。
(4)间接电化学法除NO。其原理如图丙所示,写出电解池阴极的电极反应式(阴极室溶液呈酸性):________________;吸收池中除去NO的原理:________________ (用离子方程式表示)。
【答案】 CO2 (g) +4H2(g) ![]() CH4 (g) +2H2O (g) ΔH= - 163kJ/mol 减小 1.6mol/L 1:1 3: 1 1.5×10-4 3:1 2HSO3-+2e-+2H+ ═S2O42-+2H2O 2NO + 2S2O42-+2H2O═N2 + 4HSO3-
CH4 (g) +2H2O (g) ΔH= - 163kJ/mol 减小 1.6mol/L 1:1 3: 1 1.5×10-4 3:1 2HSO3-+2e-+2H+ ═S2O42-+2H2O 2NO + 2S2O42-+2H2O═N2 + 4HSO3-
【解析】(1)用CO2和H2为原料可得到CH4燃料的反应方程式为:CO2+4H2![]() CH4+2H2O,已知:①CH4( g) +CO2( g)
CH4+2H2O,已知:①CH4( g) +CO2( g) ![]() 2CO( g)+2H2( g) △H1=+247kJ·mol-1;②CH4(g) +H2O(g)
2CO( g)+2H2( g) △H1=+247kJ·mol-1;②CH4(g) +H2O(g) ![]() CO( g)+3H2(g) △H2=+205kJ mol-1;根据盖斯定律,由①-②×2得反应CO2 (g) +4H2(g)
CO( g)+3H2(g) △H2=+205kJ mol-1;根据盖斯定律,由①-②×2得反应CO2 (g) +4H2(g) ![]() CH4 (g) +2H2O (g) ΔH=△H1-2△H2=+247kJ·mol-1-+205kJ mol-1×2= - 163kJ/mol;(2)①将烟气通入1.0mol·L-1的Na2SO3溶液,亚硫酸与亚硫酸钠和水反应生成亚硫酸氢钠,溶液的pH不断减小,向Na2SO3溶液中通入SO2生成NaHSO3,反应方程式SO2+Na2SO3+2H2O=2NaHSO3,溶液中反应的硫酸根离子和生成硫酸氢根离子的物质的量比为1:2,即溶液中参加反应的硫酸根为(1.0-0.2)molL-1,则生成的硫酸氢根为2×(1.0-0.2)molL-1=1.6molL-1;②发生的主要反应(NH4)2SO3+H2O+SO3=2NH4HSO3,根据图像可知a点时两个比值相等,则n(HSO3-):n(H2SO3)=1:1,b点时溶液PH=7,根据电荷守恒可知n(NH4+)=n(HSO3-)+2 n(SO32-),又根据图像曲线可知,n(HSO3-)=n(SO32-),则n(NH4+):n(HSO3-)=(1+2):1=3:1。(3)①曲线a中,NO的起始浓度为6×10-4mg/m3,A点的脱除率为55%,B点的脱除率为75%,从A点到B点经过0.8s,该时间段内NO的脱除率=6×10-4mg/m3×(0.75-0.55)÷0.8s=1.5×10-4mg/(m3s);②NH3与NO的物质的量的比值越大,NO脱除率越大,故其物质的量之比分别为4:1、3:1、1:3时,对应的曲线为a、b、c,故曲线b对应NH3与NO的物质的量之比是3:1;(4)阴极是HSO3-在酸性条件下发生还原反应,生成S2O42-,其电极反应式为:2HSO3-+2e-+2H+ ═S2O42-+2H2O;。根据图示,吸收池中S2O42-和NO是反应物,N2和HSO3-是生成物,则吸收池中除去NO的原理是:2NO + 2S2O42-+2H2O═N2 + 4HSO3-。
CH4 (g) +2H2O (g) ΔH=△H1-2△H2=+247kJ·mol-1-+205kJ mol-1×2= - 163kJ/mol;(2)①将烟气通入1.0mol·L-1的Na2SO3溶液,亚硫酸与亚硫酸钠和水反应生成亚硫酸氢钠,溶液的pH不断减小,向Na2SO3溶液中通入SO2生成NaHSO3,反应方程式SO2+Na2SO3+2H2O=2NaHSO3,溶液中反应的硫酸根离子和生成硫酸氢根离子的物质的量比为1:2,即溶液中参加反应的硫酸根为(1.0-0.2)molL-1,则生成的硫酸氢根为2×(1.0-0.2)molL-1=1.6molL-1;②发生的主要反应(NH4)2SO3+H2O+SO3=2NH4HSO3,根据图像可知a点时两个比值相等,则n(HSO3-):n(H2SO3)=1:1,b点时溶液PH=7,根据电荷守恒可知n(NH4+)=n(HSO3-)+2 n(SO32-),又根据图像曲线可知,n(HSO3-)=n(SO32-),则n(NH4+):n(HSO3-)=(1+2):1=3:1。(3)①曲线a中,NO的起始浓度为6×10-4mg/m3,A点的脱除率为55%,B点的脱除率为75%,从A点到B点经过0.8s,该时间段内NO的脱除率=6×10-4mg/m3×(0.75-0.55)÷0.8s=1.5×10-4mg/(m3s);②NH3与NO的物质的量的比值越大,NO脱除率越大,故其物质的量之比分别为4:1、3:1、1:3时,对应的曲线为a、b、c,故曲线b对应NH3与NO的物质的量之比是3:1;(4)阴极是HSO3-在酸性条件下发生还原反应,生成S2O42-,其电极反应式为:2HSO3-+2e-+2H+ ═S2O42-+2H2O;。根据图示,吸收池中S2O42-和NO是反应物,N2和HSO3-是生成物,则吸收池中除去NO的原理是:2NO + 2S2O42-+2H2O═N2 + 4HSO3-。

【题目】已知常温下氯酸钾与浓盐酸反应放出氯气,现按下图进行卤素的性质实验。玻璃管内分别装有滴有不同溶液的白色棉球,反应一段时间后,对图中指定部分颜色描述正确的是( )

选项 | ① | ② | ③ | ④ |
A | 黄绿色 | 白色 | 紫色 | 白色 |
B | 黄绿色 | 橙色 | 紫色 | 黄绿色 |
C | 黄绿色 | 橙色 | 蓝色 | 白色 |
D | 黄绿色 | 橙色 | 蓝色 | 黄绿色 |
A. A B. B C. C D. D