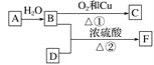
题目内容
【题目】一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合下图的是( )
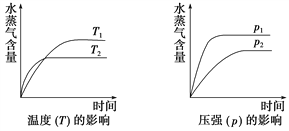
A. CO2(g)+H2(g) ![]() CO(g)+H2O(g) ΔH>0
CO(g)+H2O(g) ΔH>0
B. CH3CH2OH(g )![]() CH2===CH2(g)+H2O(g) ΔH>0
CH2===CH2(g)+H2O(g) ΔH>0
C. 2C6H5CH2CH3(g)+O2(g) ![]() 2C6H5CH===CH2(g)+2H2O(g) ΔH<0
2C6H5CH===CH2(g)+2H2O(g) ΔH<0
D. CO2(g)+2NH3(g) ![]() CO(NH2)2(s)+H2O(g) ΔH<0
CO(NH2)2(s)+H2O(g) ΔH<0
【答案】D
【解析】温度越高,反应越快,到达平衡的时间就越少,因此T2>T1;同理压强越大,反应越快,到达平衡的时间就越少,因此P1>P2;
A、该反应是吸热的可逆反应,升高温度平衡正向移动,则T2时水蒸气含量应该比T1时大,与图象不符,故A错误;
B、该反应是一个体积增大和吸热的可逆反应,升高温度平衡向正反应方向移动,水蒸气的含量增大;增大压强,平衡向逆反应方向移动,水蒸气的含量减小,不符合图象,故B错误;
C、该反应是一个体积增大和放热的可逆反应,增大压强平衡逆向移动,水蒸气的含量减少,与图像不符,故C错误;
D、该反应是一个体积减小和放热的可逆反应,因此升高温度平衡向逆反应方向移动,水蒸气的含量降低;而增大压强平衡向正反应方向移动,水蒸气的含增大量,与图像相符,故D正确。
此题答案选D。

【题目】某厂废酸主要含硫酸、Fe3+、Fe2+、TiO2+、Al3+,利用该废液制备过二硫酸铵[(NH4)2S2O8]和TiO(OH)2的一种工艺流程如下:
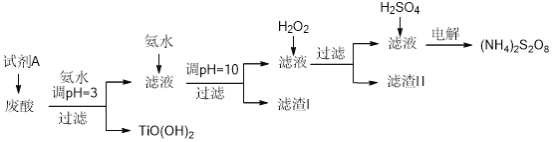
已知:i.
金属离子 | TiO2+ | Fe3+ | Fe2+ | Al3+ |
开始沉淀的pH | 1.2 | 1.9 | 7.0 | 3.2 |
沉淀完全的pH | 2.8 | 3.1 | 9.4 | 4.7 |
ii.pH>7时,Fe2+部分生成Fe(II)氨络离子[Fe(NH3)2]2+。
请回答下列问题:
(1)试剂A为__________,其作用是____________。
(2)取少量TiO(OH)2,用稀盐酸溶解,滴加少量KSCN溶液后无明显现象。再加入少量H2O2,出现微红色。焙烧TiO(OH)2获得的TiO2会发黄,发黄的杂质可能是__________(填化学式)。
(3)滤渣I的主要成分除Fe(OH)2、Al(OH)3外,还含有__________(填化学式)。
(4)加入H2O2的目的是氧化除掉Fe(II)氨络离子[Fe(NH3)2]2+,配平下列离子方程式:2[Fe(NH3)2]2++_____+4H2O+H2O2=______+4NH3·H2O
(5)过二硫酸铵中硫元素的化合价为__________。
(6)常温下,含硫微粒主要存在形式与 pH的关系如下图所示。
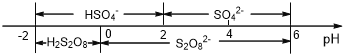
用惰性电极电解饱和NH4HSO4溶液制备过二硫酸铵时,在阳极放电的离子主要为HSO4-,则阳极区电解质溶液的pH范围为____<pH<____,其电极反应式为____________