题目内容
【题目】某厂废酸主要含硫酸、Fe3+、Fe2+、TiO2+、Al3+,利用该废液制备过二硫酸铵[(NH4)2S2O8]和TiO(OH)2的一种工艺流程如下:
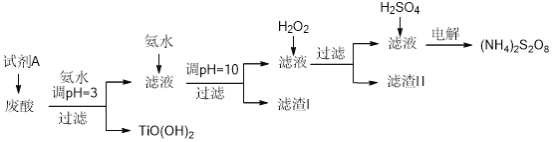
已知:i.
金属离子 | TiO2+ | Fe3+ | Fe2+ | Al3+ |
开始沉淀的pH | 1.2 | 1.9 | 7.0 | 3.2 |
沉淀完全的pH | 2.8 | 3.1 | 9.4 | 4.7 |
ii.pH>7时,Fe2+部分生成Fe(II)氨络离子[Fe(NH3)2]2+。
请回答下列问题:
(1)试剂A为__________,其作用是____________。
(2)取少量TiO(OH)2,用稀盐酸溶解,滴加少量KSCN溶液后无明显现象。再加入少量H2O2,出现微红色。焙烧TiO(OH)2获得的TiO2会发黄,发黄的杂质可能是__________(填化学式)。
(3)滤渣I的主要成分除Fe(OH)2、Al(OH)3外,还含有__________(填化学式)。
(4)加入H2O2的目的是氧化除掉Fe(II)氨络离子[Fe(NH3)2]2+,配平下列离子方程式:2[Fe(NH3)2]2++_____+4H2O+H2O2=______+4NH3·H2O
(5)过二硫酸铵中硫元素的化合价为__________。
(6)常温下,含硫微粒主要存在形式与 pH的关系如下图所示。
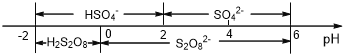
用惰性电极电解饱和NH4HSO4溶液制备过二硫酸铵时,在阳极放电的离子主要为HSO4-,则阳极区电解质溶液的pH范围为____<pH<____,其电极反应式为____________
【答案】铁粉 将Fe3+还原为Fe2+,避免Fe3+和TiO2+同时沉淀 Fe2O3 Fe(OH)3 4OH- 2Fe(OH)3![]() +6 0 2 2HSO4--2e-=S2O82-+2H+
+6 0 2 2HSO4--2e-=S2O82-+2H+
【解析】
废酸中主要含硫酸、Fe3+、Fe2+、TiO2+、Al3+,利用该废液制备过二硫酸铵[(NH4)2S2O8]和TiO(OH)2。根据流程图,用氨水调节pH=3得到TiO(OH)2,而此时铁离子也会形成沉淀,因此需要将铁离子转化为亚铁离子,因此试剂A为铁粉;滤液中加入氨水调节pH=10,得到的沉淀有氢氧化亚铁和氢氧化铝(滤渣I);滤液中含有部分Fe(II)氨络离子[Fe(NH3)2]2+,因此加入双氧水将亚铁离子氧化形成氢氧化铁沉淀(滤渣II);再在滤液中加入硫酸酸化后电解得到过二硫酸铵[(NH4)2S2O8]。据此分析解答。
(1)根据上述分析,试剂A为铁粉,主要作用是将Fe3+还原为Fe2+,避免Fe3+和TiO2+同时沉淀,故答案为:铁粉;将Fe3+还原为Fe2+,避免Fe3+和TiO2+同时沉淀;
(2)取少量TiO(OH)2,用稀盐酸溶解,滴加少量KSCN溶液后无明显现象。再加入少量H2O2,出现微红色,说明溶液中含有少量Fe3+。因此焙烧TiO(OH)2获得的TiO2会发黄,发黄的杂质为Fe2O3,故答案为:Fe2O3;
(3)根据(2)的提示,滤液中还含有少量的Fe3+,且pH=3时,铁离子不能完全沉淀,因此pH=10时产生的滤渣I的主要成分除Fe(OH)2、Al(OH)3外,还含有少量的Fe(OH)3,故答案为:Fe(OH)3;
(4)在碱性溶液中,加入H2O2的目的是氧化除掉Fe(II)氨络离子[Fe(NH3)2]2+得到氢氧化铁沉淀,根据化合价升降守恒,配平后的离子方程式为2[Fe(NH3)2]2++4OH-+4H2O+H2O2=2Fe(OH)3![]() +4NH3·H2O,故答案为:4OH-;2Fe(OH)3
+4NH3·H2O,故答案为:4OH-;2Fe(OH)3![]() ;
;
(5)过二硫酸铵[(NH4)2S2O8]中N元素为-3价,H元素为+1价,O元素为-2价,根据正负化合价的代数和为0,得到硫元素的化合价为+6,故答案为:+6;
(6)根据常温下,含硫微粒主要存在形式与 pH的关系图,阳极放电的离子主要是HSO4-,则阳极区电解质溶液的pH范围应控制在0~2,阳极发生氧化反应,HSO4-放电转化为S2O82-,则阳极的电极反应为:2HSO4--2e-═S2O82-+2H+,故答案为:0;2;2HSO4--2e-═S2O82-+2H+。