题目内容
(1)把打磨后的铝片浸入NaOH溶液中,观察到的现象是 .该反应的离子方程式为 .
(2)Na2FeO4是-种高效的自来水消毒杀菌剂,其中铁元素的化合价为 ,对自来水的消毒杀菌,是利用了Na2FeO4的强 (填氧化性或还原性).
(3)在小烧杯中加入25mL蒸馏水,加热至沸腾后,滴入5-6滴FeCl3饱和溶液,继续煮沸溶液呈现 色,停止加热,所制得的分散系为 .
(2)Na2FeO4是-种高效的自来水消毒杀菌剂,其中铁元素的化合价为
(3)在小烧杯中加入25mL蒸馏水,加热至沸腾后,滴入5-6滴FeCl3饱和溶液,继续煮沸溶液呈现
考点:铝的化学性质,胶体的重要性质,铁的氧化物和氢氧化物
专题:元素及其化合物
分析:(1)反应生成偏铝酸钠和氢气;
(2)Na为+1价,O为-2价,化合物中正负化合价的倒数和为0,处于高价的元素的物质具有强氧化性;
(3)铁离子水解生成胶体.
(2)Na为+1价,O为-2价,化合物中正负化合价的倒数和为0,处于高价的元素的物质具有强氧化性;
(3)铁离子水解生成胶体.
解答:
解:(1)反应生成偏铝酸钠和氢气,则观察到铝表面有气泡产生,离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:铝表面有气泡产生;2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)Na为+1价,O为-2价,化合物中正负化合价的倒数和为0,则Na2FeO4中Fe元素的化合价为0-(+1)×2-(-2)×4=+6,为高价的Fe元素,则具有强氧化性,
故答案为:+6;强氧化性;
(3)在小烧杯中加入25mL蒸馏水,加热至沸腾后,滴入5-6滴FeCl3饱和溶液,继续煮沸溶液呈现红褐色,停止加热,所制得的分散系为胶体,故答案为:红褐;胶体.
故答案为:铝表面有气泡产生;2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)Na为+1价,O为-2价,化合物中正负化合价的倒数和为0,则Na2FeO4中Fe元素的化合价为0-(+1)×2-(-2)×4=+6,为高价的Fe元素,则具有强氧化性,
故答案为:+6;强氧化性;
(3)在小烧杯中加入25mL蒸馏水,加热至沸腾后,滴入5-6滴FeCl3饱和溶液,继续煮沸溶液呈现红褐色,停止加热,所制得的分散系为胶体,故答案为:红褐;胶体.
点评:本题考查较综合,涉及Al的化学性质、元素的化合价及性质、胶体制备等,注重基础知识的考查,题目较简单.

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案
相关题目
在一定温度下,反应A2(g)+B2(g)═2AB(g)达到反应限度的标志是( )
| A、容器内气体的总压强不随时间变化而变化 |
| B、A2和B2物质的量之和与AB的物质的量相等 |
| C、c(A2):c(B2):c(AB)=1:1:2 |
| D、A2、B2和AB的物质的量不再改变 |
下列物质能用铁制器皿盛放的是( )
| A、浓硫酸 | B、稀硫酸 |
| C、氯化铜溶液 | D、氯化铁溶液 |
如图所示是五种短周期元素化合价与原子序数的关系,有关说法不正确的是( )
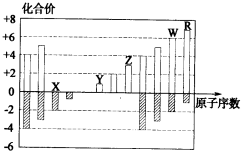

| A、原子半径:R>W>Z>Y>X |
| B、五种原子的核外最外层电子数总和为23 |
| C、X与Y可形成既含离子键又含共价键的化合物 |
| D、X、Y、W可能形成水溶液呈碱性的化合物 |
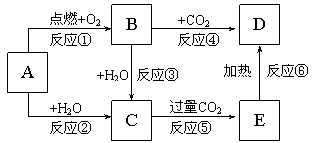
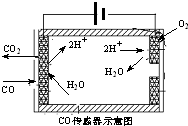 汽车在现代生活中扮演着越来越重要的角色,但其尾气(碳氢化合物、氮氧化物及一氧化碳等)带来的环境污染越来越明显,机动车废气排放已成为城市大气污染的重要来源.
汽车在现代生活中扮演着越来越重要的角色,但其尾气(碳氢化合物、氮氧化物及一氧化碳等)带来的环境污染越来越明显,机动车废气排放已成为城市大气污染的重要来源. 请按要求回答下列问题:
请按要求回答下列问题: