题目内容
2.对反应:4NH3+5O2═4NO+6H2O来说,改变下列条件使反应速率加大,其中是由于增大了“单位体积内的活化分子数”的是( )| A. | 用铂作催化剂 | B. | 升高温度 | ||
| C. | 缩小体积增大压强 | D. | 增大接触面积 |
分析 催化剂、升温、中等压强、中等接触面积都可以中等反应速率,增大了“活化分子”的百分数,可升高温度,或加入催化剂,压强增大,增大了“单位体积内的活化分子数,以此解答该题.
解答 解:A、催化剂增大反应速率,是单位体积内的活化分子数增大,活化分子百分数也增大的原因,故A错误;
B、升温反应速率增大,是增大活化分子数,活化分子百分数也增大,故B错误
C、缩小体积增大压强,增大了“单位体积内的活化分子数”增大反应速率,故C正确;
D、增大接触面积增大反应速率,单位体积内的活化分子数不变,故D错误;
故选C.
点评 本题考查了化学反应速率影响因素分析,改变条件对活化分子数的变化的判断,掌握基础是解题关键,题目难度中等.

练习册系列答案
 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
13.某城市有甲、乙两种工厂排放污水,污水中各含有下列6种离子中的3种(两厂不含相同离子):H+、Ba2+、Na+、OH-、CO32-、NO3-.两厂单独排放都会造成严重的水污染,若将两厂的污水按一定比例混合,便会变成无色澄清只含硝酸钠的溶液.关于污染源的分析,你认为正确的是( )
| A. | CO32-和NO3-来自同一工厂 | B. | OH-和NO3-一定不在同一工厂 | ||
| C. | H+和Ba2+一定不在同一工厂 | D. | Na+和NO3-来自同一工厂 |
10.为达到预期的实验目的,下列操作正确的是( )
| A. | 欲制备Fe(OH)3 胶体,向盛有沸水的烧杯中滴加FeCl3饱和溶液并长时间煮沸 | |
| B. | 用碘的水溶液鉴别乙醇、四氯化碳 | |
| C. | 欲配制质量分数为10%的CuSO4溶液,将l0 g CuSO4•5H2O 溶解在90 g 水中 | |
| D. | 为减小误差,容量瓶必须干燥后才可使用 |
17.下列各物质中,按熔点由高到低的顺序排列正确的是( )
| A. | F2>Cl2>Br2>I2 | B. | KCl>NaCl,CaO>MgO | ||
| C. | Rb>K>Na>Li | D. | SiO2>CaCl2>CBr4>CF4 |
7.下列两种气体的分子数一定相等的是( )
| A. | 质量相等、密度不等的N2和C2H4 | B. | 相同压强、相同体积的CO和O2 | ||
| C. | 相同温度、相同体积的O2和N2 | D. | 质量相等的N2和CO2 |
16.已知25℃时:
①HF(aq)+OH-(aq)?F-(aq)+H2O(1)△H=-67.7kJ/mol
②H+(aq)+OH-(aq)═H2O(1)△H=-57.3kJ/mol
下列有关说法中正确的是( )
①HF(aq)+OH-(aq)?F-(aq)+H2O(1)△H=-67.7kJ/mol
②H+(aq)+OH-(aq)═H2O(1)△H=-57.3kJ/mol
下列有关说法中正确的是( )
| A. | HF电离吸热 | |
| B. | 水解消耗0.1 mol F时,吸收的热量为6.77 kJ | |
| C. | 中和热均为57.3 kJ/mol | |
| D. | 含0.1 mol HF、0.1 mol NaOH的两种溶液混合后放出的热量为6.77 kJ |
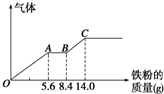 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体).请填空:
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体).请填空: