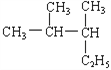
��Ŀ����
����Ŀ��ijС����ʵ��1��֤FeCl3��Cu�ķ�Ӧ���۲쵽�а�ɫ�������������������������̽����
ʵ��1��
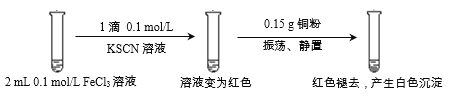
���ϣ�
i. CuSCN��CuCl��Ϊ������ˮ�İ�ɫ���壻���������ᷴӦ���ֱ�����Cu2+��SO42-��Cu2+��Cl-��
ii. SCN-����Ϊ��±�����ӣ�������±���������ƣ�(SCN)2������±�ص������ƣ���ˮ��Һ�ʻ�ɫ��
��1��FeCl3��Һ��KSCN��Һ��Ӧ�����ӷ���ʽΪ__________________��
��2��������ʵ��1�õ��������У���������_______________������ĸ��ţ���
a. Cu�ܻ�ԭFe3+
b. Fe3+��SCN-�ķ�Ӧ�ǿ��淴Ӧ
c. ��ɫ�����е�Cu(I)��I��ʾ+1��ͭԪ�أ���������Fe3+����Cu�õ���
��3��Ϊ̽��ʵ��1�а�ɫ�����ijɷ֣�С��ͬѧʵʩ��ʵ��2��
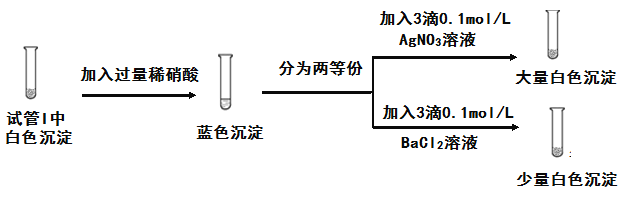
��ʵ��2��֪��ʵ��1�а�ɫ�����ijɷ���____��
��4����С������һ��̽��ʵ��1�а�ɫ����������ԭ��ʵʩ��ʵ��3��
���� | ʵ����� | ʵ������ |
I | ��Һ��Ϊ��ɫ�����������ײ�ֻ��������ɫ����ʣ�� | |
II | ȡI���ϲ���Һ���Թ��У��μ�1�� 0.1mol/L KSCN��Һ | ���̳��ֺ�ɫ��ͬʱ�а�ɫ�������� |
III | ��II���Թܣ����� | ��ɫ������࣬��ɫ����ȥ |
������I��ʵ�������_____________________��
������ʵ��3������С��ͬѧ��ΪFe3+��Cu��Ӧ���������ﲻ��Cu(I)�����ǵ��ж�������______��
������II�м���KSCN��Һ����ֺ�ɫ�Ŀ���ԭ����________________��
�����Ͳ���III��ʵ����������Ŀ���ԭ��_______________________��
���𰸡�Fe3+ + 3SCN-![]() Fe(SCN)3 abc CuCl��CuSCN ��2 mL 0.1 mol/L FeCl3��Һ�м���0.15 gͭ�ۣ������� ����Cu(I)���ɣ�����I��Ӧ����CuCl��ɫ������������I���ް�ɫ�������� Cu2+��SCN-��Ӧ����(SCN)2��Fe2+��(SCN)2����ΪFe3+ Cu2+��SCN-������Ӧ��2Cu2+ + 4SCN-= 2CuSCN��+ (SCN)2��CuSCN��Cl-��������ת����Ӧ��CuSCN + Cl-=CuCl + SCN-��SCN-������Cu2+��Ӧ�����°�ɫ������ࣻ���ŷ�Ӧ�Ľ���SCN-�����ģ�ƽ��Fe3+ + 3SCN-
Fe(SCN)3 abc CuCl��CuSCN ��2 mL 0.1 mol/L FeCl3��Һ�м���0.15 gͭ�ۣ������� ����Cu(I)���ɣ�����I��Ӧ����CuCl��ɫ������������I���ް�ɫ�������� Cu2+��SCN-��Ӧ����(SCN)2��Fe2+��(SCN)2����ΪFe3+ Cu2+��SCN-������Ӧ��2Cu2+ + 4SCN-= 2CuSCN��+ (SCN)2��CuSCN��Cl-��������ת����Ӧ��CuSCN + Cl-=CuCl + SCN-��SCN-������Cu2+��Ӧ�����°�ɫ������ࣻ���ŷ�Ӧ�Ľ���SCN-�����ģ�ƽ��Fe3+ + 3SCN- ![]() Fe(SCN)3�����ƶ������º�ɫ����ȥ
Fe(SCN)3�����ƶ������º�ɫ����ȥ
��������
��1��FeCl3��Һ��KSCN��Һ��Ӧ�����ӷ���ʽΪFe3+ + 3SCN- ![]() Fe(SCN)3��
Fe(SCN)3��
����Fe3+ + 3SCN- ![]() Fe(SCN)3��
Fe(SCN)3��
��2��a. ����Cu����Һ��ɫ��ȥ��������ɫ���壬�����֪��Ϣ��CuSCN��CuCl��Ϊ������ˮ�İ�ɫ���壬˵����Һ��������������ʧ��ͭ����ת��Ϊ��ͭ���ӣ���֤��ͭ����Һ�е�Fe3+����������ԭ��Ӧ�����������ӻ��ϼ۽��ͣ�����ԭ����a��ȷ��
b. ͭ����Һ�е�Fe3+������Ӧʱ����Һ��Fe3+Ũ�ȼ�С��ʹ��ӦFe3+ + 3SCN- ![]() Fe(SCN)3 �����ƶ���Fe(SCN)3 ���٣���Һ��ɫ�������˵��Fe3+��SCN-�ķ�Ӧ�ǿ��淴Ӧ����b��ȷ��
Fe(SCN)3 �����ƶ���Fe(SCN)3 ���٣���Һ��ɫ�������˵��Fe3+��SCN-�ķ�Ӧ�ǿ��淴Ӧ����b��ȷ��
c. ͭԪ����0�۱�Ϊ+1�ۣ����ϼ����߱���������Һ�к���Cl-��SCN-��Fe3+��K+��Cl-Ϊ-1������Ԫ�ص���ͼۣ�ֻ���л�ԭ�ԣ�SCN-����Ϊ��±�����ӣ�������±���������ƣ���SCN-���л�ԭ�ԣ�����ʹͭ���ʱ����������ʵĻ�ԭ��Խǿ�������ӵ�������Խ����K�Ļ�ԭ��ǿ��Fe����Fe3+��������ǿ��K+����ͭ������Fe3+����������ԭ��Ӧ����c��ȷ��
��3��������֪��Ϣ��CuSCN��CuCl��Ϊ������ˮ�İ�ɫ���壻���������ᷴӦ��������������ԣ�����ͭ���Ӻ�SCN-�������ֱ�����Cu2+��SO42-��Cu2+��Cl-������ͼ�з�Ӧ���������������Һ�м�����������������ɫ������˵����Һ�к���Cl-���������������Һ�м����Ȼ�����������ɫ������˵����Һ�к���SO42-���ʸ������Ϸ�����֪��ʵ��1�а�ɫ�����ijɷ���CuSCN��CuCl��
����CuSCN��CuCl��
��4���ٽ��ʵ��1������I�е�ʵ������Ҫ��һ��̽��ʵ��1�а�ɫ����������ԭ����Ҫͭ���Ȼ�����Һ��Ӧ������I��ʵ���������2 mL 0.1 mol/L FeCl3��Һ�м���0.15 gͭ�ۣ������ã�
��Ϊ����2 mL 0.1 mol/L FeCl3��Һ�м���0.15 gͭ�ۣ������ã�
��Fe3+��Cu��Ӧ����Cu(I)���ɣ�����I��Ӧ����CuCl��ɫ������������I������Ϊ��Һ��Ϊ��ɫ�����������ײ�ֻ��������ɫ����ʣ�ࣻ�ް�ɫ��������������ΪFe3+��Cu��Ӧ���������ﲻ��Cu(I)��
��Ϊ������Cu(I)���ɣ�����I��Ӧ����CuCl��ɫ������������I���ް�ɫ����������
�۲���II�м���KSCN��Һ����ֺ�ɫ��ͬʱ�а�ɫ�������ɣ�˵��Cu2+��SCN-��Ӧ����(SCN)2����ͭ���ӣ���ͭ�����������ӽ������CuCl��ɫ������(SCN)2��±�ص��ʵ��������ƣ�Fe2+��(SCN)2����ΪFe3+��Fe3+��SCN-������ɫ��Һ��
��Ϊ��Cu2+��SCN-��Ӧ����(SCN)2��Fe2+��(SCN)2����ΪFe3+��
��Cu2+��SCN-������Ӧ��2Cu2+ + 4SCN-= 2CuSCN��+ (SCN)2��CuSCN��Cl-��������ת����Ӧ��CuSCN + Cl-=CuCl + SCN-��SCN-������Cu2+��Ӧ�����°�ɫ������ࣻ���ŷ�Ӧ�Ľ���SCN-�����ģ�ƽ��Fe![]() Fe(SCN)3�����ƶ������º�ɫ����ȥ��
Fe(SCN)3�����ƶ������º�ɫ����ȥ��
��Ϊ��Cu2+��SCN-������Ӧ��2Cu2+ + 4SCN-= 2CuSCN��+ (SCN)2��CuSCN��Cl-��������ת����Ӧ��CuSCN + Cl-=CuCl + SCN-��SCN-������Cu2+��Ӧ�����°�ɫ������ࣻ���ŷ�Ӧ�Ľ���SCN-�����ģ�ƽ��Fe3+ + 3SCN- ![]() Fe(SCN)3�����ƶ������º�ɫ����ȥ��
Fe(SCN)3�����ƶ������º�ɫ����ȥ��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ��ijС�����ʵ�����ȼ�յIJ��P�����ʽ�����֤��ʵ��װ������ͼ��ʾ��
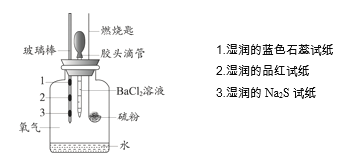
����ʵ����ʵ�����ý����������
ʵ����ʵ | ���ý��� | |
A | ʪ���Ʒ����ֽ��ɫ | ֤����ȼ�յIJ�������SO2 |
B | ʪ���Na2S��ֽ�ϳ��ֵ���ɫ���� | ֤�����ȼ�ղ����ܱ���ԭ���� |
C | ʪ�����ɫʯ����ֽ��� | ֤�����ȼ�ղ��������������� |
D | ����BaCl2��Һ������ɫ���� | ֤����ȼ�յIJ�������SO3 |
A.AB.BC.CD.D