题目内容
【题目】在容积为1.00L的容器中,通入一定量的![]() ,发生反应
,发生反应![]() 。100℃时,体系中各物质浓度随时间变化如图所示。80s时,改变反应温度为T,
。100℃时,体系中各物质浓度随时间变化如图所示。80s时,改变反应温度为T,![]() 的浓度以
的浓度以![]() 的平均反应速率降低,经10s又达到平衡。
的平均反应速率降低,经10s又达到平衡。

完成下列填空:
(1)比较N、O的原子半径:![]() ________
________![]() (选填“
(选填“![]() ”或“
”或“![]() ”)。
”)。
(2)在0-60s时段,反应速率![]() ________
________![]() 。
。
(3)若在相同情况下最初向该容器充入的是![]() 气体,要达到上述同样的状态,
气体,要达到上述同样的状态,![]() 的起始浓度是________mol/L。
的起始浓度是________mol/L。
(4)T_____100℃(选填“![]() ”或“
”或“![]() ”),判断理由是________________。
”),判断理由是________________。
(5)画出容器在80-90s时段内![]() 和
和![]() 的浓度变化________。
的浓度变化________。
【答案】大于 0.06 0.2 大于 该反应正向吸热,改变温度,反应向吸热方向进行,故温度升高(或者改变温度后反应速率加快,故温度升高) 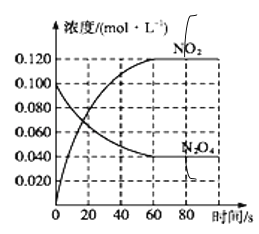
【解析】
(1)同周期中从左到右元素原子的半径依次减小;
(2)根据化学反应速率的定义解答;
(3)达到上述同样的平衡状态,为等效平衡,按化学计量数换算到N2O4一边满足c(N2O4)为0.100mol/L;
(4)N2O4的浓度降低,平衡向正反应方向移动,由于正反应方向吸热,T>100℃;
(5)依据题中改变温度,N2O4的浓度降低,则可推知平衡向正反应方向移动,再结合物质的速率之比等于参加反应的化学计量数之比得出NO2的浓度增加量。
(1)N与O均位于第二周期,N的原子序数小于O,则![]() 大于
大于![]() ;
;
(2)在0-60s时段,N2O4的浓度从0.100 mol/L降低到0.040mol/L,则反应速率![]()
![]() =0.06
=0.06![]() ;
;
(3)达到上述同样的平衡状态,为等效平衡,按化学计量数换算到N2O4一边满足c(N2O4)为0.1mol/L,由N2O42NO2,可知c(NO2)=2c(N2O4)=2×0.1mol/L=0.2mol/L,故答案为:0.2mol/L;
(4)N2O4的浓度降低,平衡向正反应方向移动,由于正反应方向吸热,T>100℃,故答案为:大于;该反应正向吸热,改变温度,反应向吸热方向进行,故温度升高(或者改变温度后反应速率加快,故温度升高);
(5)80s时,改变反应温度为T,![]() 的浓度以
的浓度以![]() 的平均反应速率降低,经10s又达到平衡,则NO2的 浓度以
的平均反应速率降低,经10s又达到平衡,则NO2的 浓度以![]() ×2=
×2=![]() ,故图像可表示为:
,故图像可表示为:
 。
。

 阅读快车系列答案
阅读快车系列答案【题目】在呼吸面具和潜水艇中可用过氧化钠作为供氧剂。请选用适当的化学试剂和实验用品,用下图中的实验装置进行实验,证明过氧化钠可用做供氧剂。
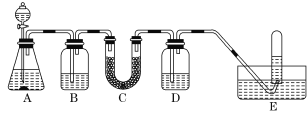
(1)A是制取CO2的装置。写出A中发生反应的化学方程式:______。
(2)填写表中空格:
仪器 | 加入试剂 | 加入该试剂的目的 |
B | 饱和NaHCO3溶液 | 除去CO2中混有的HCl |
C | Na2O2 | _______ |
D | NaOH溶液 | _______ |
(3)写出Na2O2与CO2反应的化学方程式:______。
(4)试管中收集满气体后,下一步实验操作及现象、结论是___。
【题目】体操运动员在完成单杠、吊环项目时常用“镁粉”搓手,以起到防滑效果。某种“镁粉”中可能含有Mg、MgO、Mg(OH)2、MgCO3中的一种或两种固体,实验小组对其成分展开了探究。
已知:MgO+2HCl=MgCl2+H2O MgCO3+2HCl=MgCl2+H2O+CO2↑
(1)探究“镁粉”中是否含有Mg和MgCO3
①取少量样品,如图所示进行实验。观察到a试管中有气泡产生,b试管中产生的现象是澄清石灰水变浑浊,则证明“镁粉”中一定含有______。

②为证明“镁粉”中是否含有Mg,小明将燃着的木条放在图中b试管口上方,木条熄灭。但同学们指出,该实验不能达成实验目的,需要将图中的澄清石灰水替换成浓NaOH溶液,目的是______________。小明按照修改后的实验方案重复上述实验,观察到b试管中无明显现象,证明“镁粉”中______________。
(2)探究“镁粉”中是否还含有MgO及Mg(OH)2
【实验过程】
Ⅰ.用MgO、Mg(OH)2和MgCO3三种固体分别做性质实验。分别取0.5g三种固体粉末,每次取样方法如图2所示:

逐滴加入相同溶质质量分数的稀盐酸直至粉末恰好消失。在下表中记录消耗的同浓度稀盐酸的体积(以下体积均在同一条件下测定,且保留到小数点后1位)
MgO | Mg(OH)2 | MgCO3 | |
消耗稀盐酸的体积 /mL | 10.4 | 7.2 | 5.0 |
Mg(OH)2与盐酸发生中和反应的化学方程式为_____________。
Ⅱ.取“镁粉”样品0.5 g,加入上述稀盐酸至粉末恰好溶解。此时消耗稀盐酸的体积约为5.3 mL。
【实验分析及结论】
“镁粉”不只含有MgCO3。理由是____________________________________。
【实验反思】
为确定“镁粉”的具体成分,同学们认为还需要补充如下实验:分别取0.5 g“镁粉”和0.5 g_________,加入足量稀盐酸,测定生成的气体体积分别为119mL和140mL。由此可知“镁粉”中含有MgCO3的质量分数为___________。
【题目】化学兴趣A组的同学们利用废硫酸溶液制备K2SO4晶体,设计流程如下图所示:
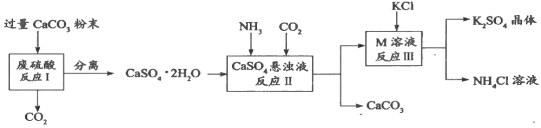
(1)写出反应Ⅰ的化学方程式:______________________。
(2)反应Ⅱ生成了一种可用作肥料的物质M,M的化学式为_________________。
(3)上述流程中可循环使用的物质有CO2和_________(填化学式)。
(4)反应Ⅲ中相关物质在25℃时的溶解度如下表。
物质 |
|
|
|
|
溶解度/g | 34.0 | 11.1 | 37.2 | 19.5 |
反应Ⅲ在常温下(25℃)能实现的原因是_________________________。
(5)不用水而用饱和K2SO4溶液洗涤反应Ⅲ所得晶体的原因是_____________;为了检验此晶体是否洗涤干净,取最后一次洗涤液于试管中,先加入过量的_______(选填字母),振荡、静置, 再向上层清液中滴加_______(选填字母),观察现象即可判断该晶体是否洗涤干净。
A. AgNO3溶液 B. BaCl2溶液 C. Ba(NO3)2溶液 D .Ba(OH)2溶液 E. NaOH溶液