题目内容
6.某铁矿石(只含金属氧化物和SiO2)溶于过量盐酸后,过滤所得滤液可用来制氧化铁涂料.(1)向上述滤液中可加入C来证明含有Fe2+;
A.酸性KMnO4溶液 B.NaOH溶液 C.溴水 D.KSCN溶液+氯水
(2)若某铁矿石的质量为3.31g,溶于适量盐酸后,然后加过量碱溶液,生成沉淀,再灼烧沉淀,得2.40g Fe2O3,已知该铁矿石中铁的氧化物的质量分数为70%,试计算:
①该铁矿石中铁的质量分数为50.8%;
②该铁矿石中铁的氧化物的化学式Fe3O4;
(3)若滤液为1L AlCl3和FeCl3混合溶液,向其中加入含a mol NaOH溶液时,产生的沉淀量可达最大值,继续加入NaOH溶液,沉淀开始溶解,当前后加入的NaOH总量达到b mol时,沉淀不再减少,则原溶液中Fe3+的物质的量浓度为$\frac{4a-3b}{3}$mol/L.
分析 (1)亚铁离子能使溴水褪色;
(2)①沉淀灼烧最后得到的固体为Fe2O3,2.40g Fe2O3中Fe元素的质量等于样品中铁元素的质量,利用Fe元素守恒计算铁矿石中铁的质量分数;
②铁矿石中铁的氧化物的质量分数为70%,3.31g某铁矿石样品,其氧化物的质量为3.31g×70%=2.317g,根据质量守恒,计算氧元素的质量,据此求出铁和氧的原子个数比,求算该铁矿石中铁的氧化物的化学式.
(3)沉淀量由最大到不再减少变化的量是Al(OH)3,结合方程式利用氢氧化钠的物质的量求出Al(OH)3的物质的量,根据Al(OH)3的物质的量求出生成Al(OH)3所用NaOH的物质的量,产生的沉淀量达最大值时使用的氢氧化钠的物质的量减去生成Al(OH)3所用NaOH的物质的量,就是生成Fe(OH)3时使用的氢氧化钠的物质的量,再根据方程式求出FeCl3的物质的量,根据物质的量浓度浓度公式求出浓度即可.
解答 解:(1)铁的氧化物溶于盐酸形成的溶液中含有铁离子和亚铁离子,亚铁离子能是溴水褪色,可以用溴水检验,由于溶液中含有铁离子所以不能用NaOH检验,也不能用KSCN溶液和氯水检验,高锰酸钾能与盐酸生成氯气也不能检验;
故答案为:C;
(2)①沉淀灼烧最后得到的固体为Fe2O3,2.40g Fe2O3中Fe元素的物质的量n(Fe)=$\frac{2.4g}{160g/mol}$×2=0.03mol,
铁矿石中铁的质量分数为:$\frac{0.03mol×56g/mol}{3.31g}$×100%≈50.8%,
故答案为:50.8%;
②铁矿石中铁的氧化物的质量分数为70%,3.31g某铁矿石样品,其氧化物的质量为3.31g×70%=2.317g,
铁的氧化物中氧元素的质量为:2.317g-0.03mol×56g/mol=0.637g,
则n(O)=$\frac{0.637g}{16g/mol}$≈0.04mol,n(Fe):n(O)=0.03:0.04=3:4,故铁的氧化物的化学式为Fe3O4,
故答案为:Fe3O4;
(3)开始产生沉淀至沉淀量达最大值发生反应:
FeCl3+3NaOH=Fe(OH)3↓+3NaCl
AlCl3+3NaOH=Al(OH)3↓+3NaCl
继续加入NaOH溶液,沉淀开始溶解至沉淀完全不再减少发生反应:
Al(OH)3+NaOH=NaAlO2+2H2O
沉淀开始溶解至沉淀完全不再减少,使用NaOH的物质的量为(b-a)mol,Al(OH)3与NaOH发生反应的物质的量之比是1:1,
所以,Al(OH)3的物质的量是(b-a)mol;
根据方程式:AlCl3+3NaOH=Al(OH)3↓+3NaCl,当有(b-a)molAl(OH)3生成时,需要NaOH的物质的量是Al(OH)3的3倍,
所以需要NaOH的物质的量是3(b-a)molAl;
与氯化铁反应的NaOH的物质的量为amol-3(b-a)mol=(4a-3b)mol,
根据反应方程式:FeCl3+3NaOH=Fe(OH)3↓+3NaCl知,生成Fe(OH)3所用NaOH物质的量是FeCl3的3倍,所以FeCl3的物质的量是$\frac{4a-3b}{3}$mol,
因为溶液的体积是1L,所以FeCl3的物质的量浓度是:$\frac{4a-3b}{3}$mol/L,
故答案为:$\frac{4a-3b}{3}$mol/L.
点评 本题考查了离子检验、有关化学方程式的计算,题目难度中等,注意根据相关反应的离子方程式计算该题,答题时注意体会做题思路.

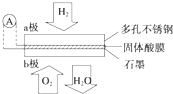 某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构如图,电池总反应可表示为:2H2+O2═2H2O,下列有关说法正确的是( )
某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构如图,电池总反应可表示为:2H2+O2═2H2O,下列有关说法正确的是( )| A. | b极上的电极反应式为:O2+2H2O+4e-═4OH- | |
| B. | H+由a极通过固体酸电解质传递到b极 | |
| C. | 每转移0.1 mol电子,消耗1.12 L的H2 | |
| D. | 电子通过外电路从b极流向a极 |
| A. | 某个多电子原子的3p能级上仅有两个电子,它们的自旋状态必然相反 | |
| B. | 在一个多电子原子中,不可能有两个运动状态完全相同的电子 | |
| C. | 在一个多电子原子中,不可能有两个能量相同的电子 | |
| D. | 在一个多电子原子中,N层上的电子能量肯定比M层上的电子能量高 |
①X+H2O→W+H2
②Y+H2O→N+O2
下列说法正确的是( )
| A. | X一定是非金属单质 | B. | X一定是金属单质 | ||
| C. | Y一定是非金属单质 | D. | Y一定是金属单质 |
| A. | 氧化镁:Mg2O | B. | 氢氧化钙:Ca(HO)2 | C. | 氢氧化钠:NaOH | D. | 硫酸钾:KSO4 |

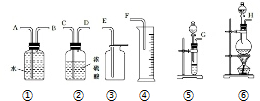 现有一定量的乙醚和乙醇的混合物试样.请从图中选用适当的实验装置,设计一个最简单的实验,测定试样中乙醇的含量.可供选用的反应物和试剂为:新制的生石灰、浓硫酸、蒸馏水、金属钠、碱石灰、无水硫酸铜.
现有一定量的乙醚和乙醇的混合物试样.请从图中选用适当的实验装置,设计一个最简单的实验,测定试样中乙醇的含量.可供选用的反应物和试剂为:新制的生石灰、浓硫酸、蒸馏水、金属钠、碱石灰、无水硫酸铜.