题目内容
【题目】在100℃时,将0.40mol NO2气体充入2L的密闭容器中,发生如下反应:2NO2(g)N2O4(g)△H<0.监测反应获得如表数据:下列说法正确的是( )
时间/s | 0 | 20 | 40 | 60 | 80 |
n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
A.0~20 s内,v(NO2)=0.005 mol?L﹣1?s﹣1
B.59 s时,c(NO2)一定大于0.12 mol?L﹣1
C.若仅将起始时充入NO2的量增至0.80 mol,则该反应的平衡常数K> ![]()
D.若上述反应在120℃时进行,则反应至80 s时,n(N2O4)<0.08 mol
【答案】D
【解析】解:A、0~20 s内,v(N2O4)= ![]() =0.00125 molL﹣1s﹣1 , 根据速率之比等于对应物质的化学计量数之比,所以v(NO2)=0.0025 molL﹣1s﹣1 , 故A错误;
=0.00125 molL﹣1s﹣1 , 根据速率之比等于对应物质的化学计量数之比,所以v(NO2)=0.0025 molL﹣1s﹣1 , 故A错误;
B、60 s时△n(N2O4)=0.08mol,所以60s时△n(NO2)=0.16mol,所以如果59 s未平衡,n(NO2)>0.40﹣0.16=0.24mol,则c(NO2)一定大于0.12 molL﹣1 , 如果平衡c(NO2)等于0.12 molL﹣1 , 故B错误;
C、60s反应达平衡状态,平衡常数为:K= 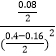 =
= ![]() ,所以若仅将起始时充入NO2的量增至0.80 mol,则该反应的平衡常数K=
,所以若仅将起始时充入NO2的量增至0.80 mol,则该反应的平衡常数K= ![]() ,故C错误;
,故C错误;
D、2NO2(g)N2O4(g)△H<0,正反应是放热反应,升高温度平衡向逆反应方向移动,所以反应在120℃时进行,则反应至80 s时,n(N2O4)<0.08 mol,故D正确;
故选D.
【考点精析】通过灵活运用化学平衡状态本质及特征,掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效)即可以解答此题.

【题目】已知硫酸、氨水的密度与所加水的量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
溶质的物质的量浓度/molL﹣1 | 溶液的密度/gcm﹣3 | |
硫酸 | c1 | ρ1 |
氨水 | c2 | ρ2 |

(1)表中硫酸的质量分数为(不写单位,用含c1、ρ1 , 的代数式表示).
(2)物质的量浓度为c1molL﹣1的硫酸与水等体积混合(混合后溶液的体积变化忽略不计),所得溶液的物质的量浓度为molL﹣1 .
(3)将物质的量浓度分别为c2molL﹣1和 ![]() c2molL﹣1的氨水等质量混合,所得溶液的密度(填“大于”、“小于”或“等于”,下同)ρ2gcm﹣3 , 所得溶液的物质的量浓度
c2molL﹣1的氨水等质量混合,所得溶液的密度(填“大于”、“小于”或“等于”,下同)ρ2gcm﹣3 , 所得溶液的物质的量浓度 ![]() c2molL﹣1(设混合后溶液的体积变化忽略不计)
c2molL﹣1(设混合后溶液的体积变化忽略不计)
【题目】如表中评价合理的是( )
选项 | 化学反应及其离子方程式 | 评价 |
A | 铁与稀盐酸反应: | 正确 |
B | 大理石溶于醋酸的反应: | 错误,醋酸应写为分子形式CH3COOH,CaCO3应写成离子形式 |
C | FeCl3溶液“腐蚀”铜箔: | 正确 |
D | NH4HCO3溶液与过量NaOH浓溶液共热:NH4++OH﹣ | 错误,HCO3﹣也可以与OH﹣反应 |
A.A
B.B
C.C
D.D



