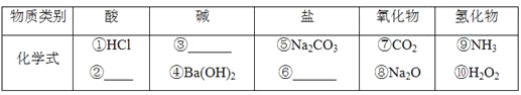
题目内容
【题目】实验室用如图所示装置来制取氯气,该装置由A、B、C三个基本装置组合而成,请回答下列问题:
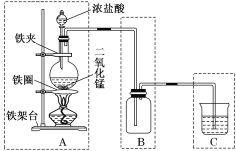
(1)说出A、B、C三个基本装置的名称:A是________装置,B是________装置,C是________装置。
(2)C装置中烧杯内所装液体是________溶液。
(3)写出A装置中反应的化学方程式_____________________________。
(4)氯气工业制法的原理为:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑。
2NaOH+H2↑+Cl2↑。
此反应的氧化剂是________,________元素的化合价升高;还原剂是_________,而________元素的化合价降低。该反应中4mol氧化剂能得到(失去)________mol电子。标准状况下,反应中产生了5.6L的氢气时,被氧化的物质的质量为_________。
【答案】气体发生 气体收集(或集气) 尾气吸收 NaOH MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O H2O H NaCl Cl 4 29.25g
MnCl2+Cl2↑+2H2O H2O H NaCl Cl 4 29.25g
【解析】
(1)典型的制气装置分为四部分:气体发生装置→气体净化装置→气体收集装置→尾气吸收装置,据此进行分析。
(2)C装置是尾气吸收装置,用氢氧化钠溶液吸收多余的氯气防止污染;
(3) MnO2和浓盐酸加热反应制取氯气,据反应规律写出化学方程式;
(4) 2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑反应中氯化钠做还原剂,水做氧化剂,根据氧化还原反应规律进行分析和计算。
2NaOH+H2↑+Cl2↑反应中氯化钠做还原剂,水做氧化剂,根据氧化还原反应规律进行分析和计算。
(1)典型的制气装置分为四部分:气体发生装置→气体净化装置→气体收集装置→尾气吸收装置,则由装置图可知各部分的用途,A是气体发生装置,B是气体收集或集气装置,C是尾气吸收装置;
综上所述,本题答案是:气体发生,气体收集(或集气) ,尾气吸收。
(2)C装置是尾气吸收装置,目的是吸收多余的氯气防止污染,一般用碱溶液吸收,故烧杯内所装液体可以是NaOH溶液;
综上所述,本题答案是:NaOH。
(3) MnO2和浓盐酸反应制取氯气的化学方程式为MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
综上所述,本题答案是:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
(4) 该反应中水中的氢元素由+1价降低到0价,发生还原反应,水做氧化剂;氯化钠中的氯元素化合价由-1价升高到0价,发生氧化反应,氯化钠做还原剂;根据反应可知,1molH2O参加反应,只有1molH被还原,得到1mol电子,因此该反应中4mol氧化剂(水)参加反应能得到4mol电子;5.6L的氢气的物质的量为5.6L/22.4L/mol=0.25mol;根据反应关系可知:2NaCl-- Cl2,所以被氧化的氯化钠的质量=0.25×2×58.5=29.25g;
综上所述,本题答案是:H2O,H,NaCl,Cl,4,29.25g。

 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案