��Ŀ����
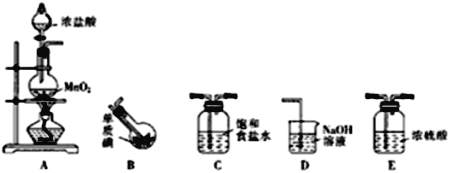
����Ŀ��ijʵ��С���һ����Al3+��δ֪��Һ���������·�����
��1�����������������ƣ������Ա仯��
��2�������μ�NaOH��Һ����ɫ������
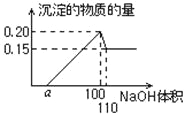
��3������������������ƣ���ɫ�������Լ��١�ʵ��С�龭�����������ó���ͼ��ʾ���������������������Ĺ�ϵ������˵���������
A. ��δ֪��Һ�����ٺ���3��������
B. �μӵ�NaOH��Һ�����ʵ���Ũ��Ϊ5mol��L-1
C. �������ճ������ˡ�ϴ�ӡ����գ�������һ��Ϊ6 g
D. ����һ������Ϊ���������ӣ���a��10
���𰸡�C
�����������������������ƣ������Ա仯��˵�����������ӣ����������������Һ�����࣬���������ʵ������������٣�˵�������������һ�ֽ��������ӣ���A��ȷ������ͼʾ���������������ʵ�����0.05mol����������������Һ�����100![]() 110mL֮�䷢��
110mL֮�䷢��![]() ,������������0.05mol���������Ƶ�Ũ����0.05mol��0.01L=5mol��L-1����B��ȷ��ʣ��ij���Ϊ�����ʵ���Ϊ0.15mol������֪ʣ��������������ʣ���C����������һ������Ϊ�����������������ɳ��������������Ƶ����ʵ���Ϊ0.15mol��2��0.05mol��3=0.45mol����������������Һ�����Ϊ0.45mol��5mol��L-1=0.09L������a��10����D��ȷ��
,������������0.05mol���������Ƶ�Ũ����0.05mol��0.01L=5mol��L-1����B��ȷ��ʣ��ij���Ϊ�����ʵ���Ϊ0.15mol������֪ʣ��������������ʣ���C����������һ������Ϊ�����������������ɳ��������������Ƶ����ʵ���Ϊ0.15mol��2��0.05mol��3=0.45mol����������������Һ�����Ϊ0.45mol��5mol��L-1=0.09L������a��10����D��ȷ��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ��T��W��X��Y��Z��Ԫ�����ڱ�ǰ�������еij���Ԫ�أ�ԭ�������������������Ϣ���±���
Ԫ�� | �����Ϣ |
T | TԪ�ؿ��γ���Ȼ��Ӳ�����ĵ��� |
W | W��Tͬ���ڣ�������һ��δ�ɶԵ��� |
X | Xԭ�ӵĵ�һ���������ĵ����ֱܷ�I1=578 kJ/mol�� I2= l817 kJ/mol�� I3=2745 kJ/mol��I4=11575kJ/mol |
Y | ���³�ѹ�£�Y�����ǹ��壬�����������γ��������Ҫ���� |
Z | Z��һ��ͬλ�ص�������Ϊ63��������Ϊ34 |
��1��TY2�Ľṹʽ��__________��__________(����Է��ӡ��Ǽ��Է��ӡ�����1mol�÷����д���________���Ҽ���

��2����̬Yԭ���У�����ռ�ݵ�����ܲ����Ϊ__________�����ܲ���е�ԭ�ӹ����Ϊ_____________��������Ϊ_________��Y������WԪ�صĵ縺���ɴ�С��˳��Ϊ_________(��Ԫ�ط�������)��
��3����֪Z�ľ����ṹ��ͼ��ʾ����֪Z���ܶ�Ϊa g/cm3����Z �İ뾶Ϊ___________pm��ZYO4�������Һ������YO42-�ĵȵ�������__________������Yԭ�ӵ��ӻ����������___________��Ԫ��Z������������е������Լ�������Ӧ�����ɳ����Z +HCl+O2=ZC1+HO2��HO2(������)������һ���������Ҳ��һ�����ɻ������м��ߵĻ��ԡ�����˵�����ʾ��ȷ����___________��
A��O2�������� B��HO2����������
C��HO2�ڼ������ȶ����� D��1 mol Z�μӷ�Ӧ��1 mol���ӷ���ת��