题目内容
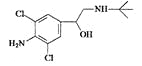
【题目】(一)莽草酸是合成治疗禽流感的药物——达菲的原料之一。莽草酸是A的一种同分异构体,A的结构简式为
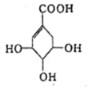
回答下列问题:
(1)A的分子式为 。
(2)A可能发生的化学反应有 。(填编号)
①能使溴的四氯化碳溶液和酸性高锰酸钾溶液褪色
②可发生酯化反应
③可与氢氧化钠溶液发生中和反应
④可与金属钠发生置换反应
⑤在铜或银的催化作用下,可被空气中的氧气氧化
(二)乙醇在能源、生产及日常生活等许多方面都有十分广泛的应用。请计算:
(1)将足量乙醇与9.2g金属钠充分反应,则标准状况下生成气体的体积是 L。
(2)若一定量的乙醇和O2在密闭容器中燃烧后的产物为CO2、CO和H2O(g)。产物依次经过浓硫酸和碱石灰使其被充分吸收,浓硫酸增重10.8g,碱石灰重13.2g。求氧气的的物质的量是 mol,燃烧产物的平均摩尔质量是 。
【答案】(一)(1)C7H10O5 ;(2)①②③④⑤;
(二)(1)4.48 ;(2)0.55;26.8g/mol。
【解析】
试题分析:根据物质的结构简式可知A的分子式是C7H10O5 ;(2)①A含有碳碳双键,能使溴的四氯化碳溶液褪色,含有碳碳双键和醇羟基,可以被酸性高锰酸钾溶液氧化而使其褪色,正确;② A含有羧基和醇羟基,可发生酯化反应,正确;③A含有羧基,可与氢氧化钠溶液发生中和反应,正确;④A含有羧基和醇羟基,可与金属钠发生置换反应产生氢气,正确;⑤由于醇羟基连接的碳原子上含有H原子,所以在铜或银的催化作用下,可被空气中的氧气氧化,正确。(二)(1)9.2gNa的物质的量是n(Na)=9.2g÷23g/mol=0.4mol,根据反应方程式2CH3CH2OH+2Na![]() 2CH3CH2ONa+H2↑可知n(H2)=1/2n(Na)=0.2mol,所以V(H2)=n(H2)·Vm=0.2mol×22.4L/mol=4.48L;(2)若一定量的乙醇和O2在密闭容器中燃烧后的产物为CO2、CO和H2O(g)。产物依次经过浓硫酸和碱石灰使其被充分吸收,浓硫酸增重10.8g,n(H2O)=10.8g÷18g/mol=0.6mol,根据H元素守恒可知n(乙醇)=( 0.6mol×2)÷6=0.2mol;碱石灰重13.2g,则n(CO2)= 13.2g÷44g/mol=0.3mol,根据C元素守恒可得n(CO)= 0.2mol×2-0.3mol=0.1mol。则根据O元素守恒可知氧气的的物质的量是n(O2) =(0.3mol×2+ 0.1mol+ 0.6mol-0.2mol)÷2=0.55mol,燃烧产物的平均摩尔质量是M=(10.8g+13.2g+0.1mol×28g/mol) ÷ (0.6mol+ 0.3mol+0.1mol)= 26.8g/mol。
2CH3CH2ONa+H2↑可知n(H2)=1/2n(Na)=0.2mol,所以V(H2)=n(H2)·Vm=0.2mol×22.4L/mol=4.48L;(2)若一定量的乙醇和O2在密闭容器中燃烧后的产物为CO2、CO和H2O(g)。产物依次经过浓硫酸和碱石灰使其被充分吸收,浓硫酸增重10.8g,n(H2O)=10.8g÷18g/mol=0.6mol,根据H元素守恒可知n(乙醇)=( 0.6mol×2)÷6=0.2mol;碱石灰重13.2g,则n(CO2)= 13.2g÷44g/mol=0.3mol,根据C元素守恒可得n(CO)= 0.2mol×2-0.3mol=0.1mol。则根据O元素守恒可知氧气的的物质的量是n(O2) =(0.3mol×2+ 0.1mol+ 0.6mol-0.2mol)÷2=0.55mol,燃烧产物的平均摩尔质量是M=(10.8g+13.2g+0.1mol×28g/mol) ÷ (0.6mol+ 0.3mol+0.1mol)= 26.8g/mol。

 阅读快车系列答案
阅读快车系列答案