题目内容
【题目】设反应①Fe(s)+CO2(g) ![]() FeO(s)+CO(g) 平衡常数为 K1;反应②Fe(s)+H2O(g)
FeO(s)+CO(g) 平衡常数为 K1;反应②Fe(s)+H2O(g)![]() FeO(s)+H 2 (g) 平衡常数为 K2;
FeO(s)+H 2 (g) 平衡常数为 K2;
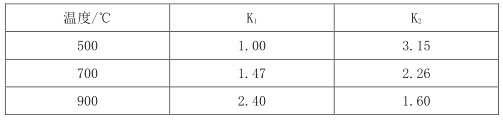
测得在不同温度下, K1、K2值如下:
(1)在500℃时进行反应①,若CO2起始浓度为1mol·L -1,10分钟后达到平衡,则V(CO)为______。
(2)在 900℃时反应 CO2 (g)+H2(g)![]() CO(g)+H2O(g)的平衡常数 K=___________。
CO(g)+H2O(g)的平衡常数 K=___________。
(3)700℃反应②达到平衡,其它条件不变时,使得该平衡向右移动,可以采取的措施有______(选填编号)。
A.缩小反应器体积 B.加入水蒸气
C.降低温度到500℃ D.加入Fe粉
(4)如果上述反应①在体积不变的密闭容器中发生,能说明反应已达到平衡状态的是________(选填编号)。
A.v正(CO)= v 逆 (CO2) B.C(CO) = C(CO2)
C.容器内气体的密度不变 D.容器内压强不变
(5)若反应①在体积固定的密闭容器中进行,在一定条件下达到平衡状态,改变下列条件再达平衡后,相应物质的物理量如何变化?(选填“增大”、“减小”或“不变”)
①降低温度,CO2的平衡浓度______________;
②再通入CO2,CO2的转化率_________________。
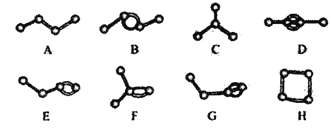
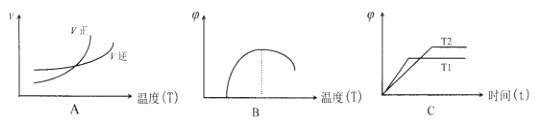
(6)下列图像符合反应①的是__________(填序号)(图中 v 是速率、φ 为混合其中CO含量,T为温度)
【答案】
(1)0.05mol/(L·min)
(2)1.5
(3) BC
(4)B
(5)① 增大②不变
(6) A
【解析】
试题分析:(1)反应①Fe(s)+CO2(g)FeO(s)+CO(g),500℃反应①的平衡常数为K1=1,根据平衡常数的表达式可知,平衡时CO2与CO的浓度相等,CO2起始浓度为2mol.L-1,根据C原子守恒,所以平衡时c(CO2)=c(CO)= ![]() ×1mol·L-1=0.5mol·L-1,
×1mol·L-1=0.5mol·L-1,
所以V(CO)为![]() =0.05mol·(L·min)-1;
=0.05mol·(L·min)-1;
(2)①Fe(s)+CO2(g)![]() FeO(s)+CO(g)平衡常数K1;反应②Fe(s)+H2O(g)FeO+H2(g)平衡常数为K2,900℃进行反应③H2(g)+CO2(g)
FeO(s)+CO(g)平衡常数K1;反应②Fe(s)+H2O(g)FeO+H2(g)平衡常数为K2,900℃进行反应③H2(g)+CO2(g)![]() H2O(g)+CO(g),其平衡常数K3=
H2O(g)+CO(g),其平衡常数K3=![]() =
=![]() =1.50;
=1.50;
(3)由(2)分析知反应②正反应为放热反应,且反应前后气体体积不变;A.缩小反应器体积,增大压强,平衡不移动,故A错误;B.加入水蒸气,反应物的浓度增加,平衡向正反应移动,故B正确;C.该反应为放热反应,降低温度平衡向正反应进行,故C正确;D.使用合适的催化剂,缩短到达平衡时间,平衡不移动.故D错误;故答案为BC;
(4)体积不变的密闭容器中发生反应Fe(s)+CO2(g)![]() FeO(s)+CO(g);A.反应达到平衡时,一氧化碳和二氧化碳生成速率相同,v正(CO)=v逆(CO2),故A正确;B.C(CO) = C(CO2)时反应不一定是平衡状态,故B错误;C.反应前后气体体积不变,平衡移动气体质量变化,容器中气体的密度不随时间而变化 说明反应达到平衡,故C正确;D.气体化学计量数变化为0,容器内压强始终不变,不一定是平衡状态,故D错误;答案为AC。
FeO(s)+CO(g);A.反应达到平衡时,一氧化碳和二氧化碳生成速率相同,v正(CO)=v逆(CO2),故A正确;B.C(CO) = C(CO2)时反应不一定是平衡状态,故B错误;C.反应前后气体体积不变,平衡移动气体质量变化,容器中气体的密度不随时间而变化 说明反应达到平衡,故C正确;D.气体化学计量数变化为0,容器内压强始终不变,不一定是平衡状态,故D错误;答案为AC。
(5)①由表中数据可知,温度越高平衡常数K1越大,所以升高温度平衡向正反应进行,升高温度平衡向吸热方向移动,即正反应为吸热反应,所以降低温度平衡向逆反应移动,CO2的平衡浓度增大;
②再通入CO2,等效为原平衡增大压强,反应前后气体体积不变,平衡不移动,转化率不变;
(6)由表中数据可知,温度越高平衡常数K1越大,所以升高温度平衡向正反应进行,升高温度平衡向吸热方向移动,即正反应为吸热反应,且反应①反应前后气体体积不变;A.处于交点时,正逆速率相等,反应处于平衡状态,当温度高于交点温度,平衡向正反应移动,说明图象表示正反应为吸热反应,符合温度变化对反应①的影响,故A正确;B.在最高点时,反应处于平衡状态,当温度高于最高点对应的温度,CO的含量降低,平衡向逆反应移动,说明图象表示正反应为放热反应,故B错误;C.到达平衡时间越短,速率越快,温度越高,所以T1>T2,温度越高,CO的含量越低,平衡向逆反应移动,说明图象表示正反应为放热反应,故C错误;故答案为A。