题目内容
【题目】NH3在工业生产上有重要的应用
(1)写出用浓氨水检验氯气管道泄漏的化学反应方程式
(2)若将少量氨气与过量氯气混合,则生成一种酸和另一种化合物A,A中所有原子均满足8电子稳定结构,试写出A的电子式;A在一定条件下能与水反应,可用于饮用水的消毒,试写出此反应的化学反应方程式 .
【答案】
(1)3Cl2+8NH3═6NH4Cl+N2
(2)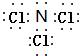 ;NCl3+3H2O=NH3+3HClO
;NCl3+3H2O=NH3+3HClO
【解析】解:(1)氯气和氨气反应生成氯化铵和氮气,反应方程式为3Cl2+8NH3═6NH4Cl+N2 , 所以答案是:3Cl2+8NH3═6NH4Cl+N2;(2)若将少量氨气与过量氯气混合,则生成一种酸和另一种化合物A,A中所有原子均满足8电子稳定结构,生成的酸是HClO,A为NCl3 , 电子式为 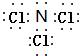 ,三氯化氮和水反应生成次氯酸和氨气,反应方程式为NCl3+3H2O=NH3+3HClO, 所以答案是:
,三氯化氮和水反应生成次氯酸和氨气,反应方程式为NCl3+3H2O=NH3+3HClO, 所以答案是: 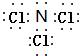 ;NCl3+3H2O=NH3+3HClO.
;NCl3+3H2O=NH3+3HClO.
【考点精析】根据题目的已知条件,利用氯气的化学性质和氨的化学性质的相关知识可以得到问题的答案,需要掌握氯气的化学性质:与金属反应将金属氧化成高价态;非金属反应;与水反应;与碱反应;与还原性物质反应;与水反应,NH3是惟一能使润湿的红色石蕊试纸交蓝的气体,常用此性质检验NH3;与酸反应:NH3+HCl=NH4Cl(生成白烟);与O2反应:4NH3+5O2=4NO+6H2O+Q;

 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案【题目】二氧化碳的捕集、利用与封存(CCUS)是我国能源领域的一个重要战略方向,CCUS或许发展成一项重要的新兴产业. 
(1)已知:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H1=a kJmol﹣1CO(g)+H2O (g)═CO2(g)+H2 (g)△H2=b kJmol﹣1
2CO(g)+O2(g)═2CO2(g)△H3=c kJmol﹣1
反应CO2(g)+CH4(g)═2CO(g)+2H2(g) 的△H=kJmol﹣1 .
(2)利用废气中的CO2为原料制取甲醇,反应方程式为:CO2+3H2═CH3OH+H2O其他条件相同,该甲醇合成反应在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下反应相同时间后,CO2的转化率随反应温度的变化如图1所示. ①a点所代表的状态(填“是”或“不是”)平衡状态.
②c点CO2的转化率高于b点,原因是 .
(3)在实际生产中发现,随着甲醇的生成,还伴随有少量CO副产物出现:CO2+H2CO+H2O△H>0,且CO2的转化率、甲醇的产率和CO含量除受浓度、度、压强等因素影响外,还受催化剂CuO的质量分数、气体混合物在反应锅炉内的流动速率影响(用空间流率表示).通过实验分别得到如下数据图2、①由图2得,最佳空间流率为h﹣1; ②在其他条件不变的前提下调整催化剂配比,并记录到达平衡所需的时间,得到如下表数据,
催化剂组分质量分数(%) | CuO | 0 | 25 | 50 | 75 | 100 |
ZnO | 100 | 75 | 50 | 25 | 0 | |
到达平衡所需时间(h) | 2.5 | 7.4 | 8.1 | 12 | 无催化活性 | |
试说明不选择单组份ZnO原因是 .
(4)用二氧化碳催化加氢来合成低碳烯烃,起始时以0.1MPa,n(H2):n(CO2)=3:1的投料比充入反应器中,发生反应:2CO2(g)+6H2(g) ![]() C2H4(g)+4H2O(g)△H,不同温度下平衡时的四种气态物质的物质的量如图4所示: ①该进行的反应的△S0(填:“>”或“<”)
C2H4(g)+4H2O(g)△H,不同温度下平衡时的四种气态物质的物质的量如图4所示: ①该进行的反应的△S0(填:“>”或“<”)
②对于气体反应,用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)也可以表示平衡常数(记作KP),则该反应的KP= .
③为提高CO2的平衡转化率,除改变温度外,还可采取的措施是(列举2项).




