题目内容
【题目】某白色固体甲常用于织物的漂白,也能将污水中的某些重金属离子还原为单质除去.为研究其组成,某小组同学进行了如下实验. 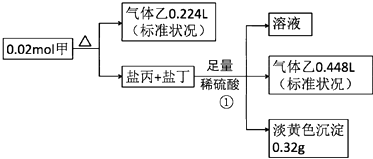
又知,甲的焰色为黄色,盐丙和丁的组成元素和甲相同,乙能使品红溶液褪色,①处气体体积在充分加热挥发后经干燥测定
(1)甲中所含阳离子的结构示意图 , 甲的化学式
(2)写出 ①中产生黄色沉淀的反应的离子反应方程式
(3)乙能使品红溶液褪色的原因是
(4)甲的溶液还可用作分析化学中的吸氧剂,假设其溶液与少量氧气反应产生等物质的量的两种酸式盐,试写出该反应的化学反应方程式
(5)下列物质中可能在溶液中与甲反应的是
A.NaI
B.Cl2
C.AgNO3
D.NaOH.
【答案】
(1) ;Na2S2O4
;Na2S2O4
(2)S2O32﹣+2H+=S↓+SO2↑+H2O
(3)能与品红结合生成不稳定的无色化合物
(4)Na2S2O4+O2+H2O=NaHSO3+NaHSO4
(5)BC
【解析】解:甲的焰色为黄色,含有Na元素,盐丙和丁的组成元素和甲相同,加入足量硫酸反应生成的乙能使品红溶液褪色,则乙为SO2 , 生成的淡黄色沉淀为S,丙、丁中其中一种为Na2S2O3 , 发生反应:Na2S2O3+H2SO4=S↓+SO2↑+Na2SO4+H2O,反应①生成的二氧化硫为 ![]() =0.02mol,硫为0.32g即0.01mol,而Na2S2O3+H2SO4=S↓+SO2↑+Na2SO4+H2O中生成的S、SO2均为0.01mol,故丙、丁中其中一种为Na2SO3 , 发生反应:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,该反应生成SO2为0.02mol﹣0.01mol=0.01mol,结合方程式可知,Na2S2O3为0.01mol,Na2SO3为0.01mol,甲分解得到二氧化硫为
=0.02mol,硫为0.32g即0.01mol,而Na2S2O3+H2SO4=S↓+SO2↑+Na2SO4+H2O中生成的S、SO2均为0.01mol,故丙、丁中其中一种为Na2SO3 , 发生反应:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,该反应生成SO2为0.02mol﹣0.01mol=0.01mol,结合方程式可知,Na2S2O3为0.01mol,Na2SO3为0.01mol,甲分解得到二氧化硫为 ![]() =0.01mol,根据原子守恒可知,0.02mol甲中含有:Na原子为0.01mol×2+0.01mol×2=0.04mol,S原子为0.01mol+0.01mol×2+0.01mol=0.04mol,O原子为(0.01mol+0.01mol)×3+0.01mol×2=0.08mol,则1mol甲含有2molNa原子、2molS原子、4molO原子,故甲的化学式为Na2S2O4 , (1)甲为Na2S2O4 , 甲中所含阳离子的结构示意图为:
=0.01mol,根据原子守恒可知,0.02mol甲中含有:Na原子为0.01mol×2+0.01mol×2=0.04mol,S原子为0.01mol+0.01mol×2+0.01mol=0.04mol,O原子为(0.01mol+0.01mol)×3+0.01mol×2=0.08mol,则1mol甲含有2molNa原子、2molS原子、4molO原子,故甲的化学式为Na2S2O4 , (1)甲为Na2S2O4 , 甲中所含阳离子的结构示意图为:  , 所以答案是:
, 所以答案是:  ;Na2S2O4;(2)①中产生黄色沉淀的反应的离子反应方程式:S2O32﹣+2H+=S↓+SO2↑+H2O,
;Na2S2O4;(2)①中产生黄色沉淀的反应的离子反应方程式:S2O32﹣+2H+=S↓+SO2↑+H2O,
所以答案是:S2O32﹣+2H+=S↓+SO2↑+H2O;(3)乙为二氧化硫,能与品红结合生成不稳定的无色化合物,使品红溶液褪色,
所以答案是:能与品红结合生成不稳定的无色化合物;(4)Na2S2O4的溶液还可用作分析化学中的吸氧剂,假设其溶液与少量氧气反应产生等物质的量的两种酸式盐,硫元素化合价升高,反应生成NaHSO3、NaHSO4 , 该反应的化学反应方程式:Na2S2O4+O2+H2O=NaHSO3+NaHSO4 ,
所以答案是:Na2S2O4+O2+H2O=NaHSO3+NaHSO4;(5)甲具有还原性,氯气具有氧化性,硝酸银溶液显酸性,具有氧化性,二者可能与甲反应,
故选:BC.

 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案