题目内容
恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应: N2(g)+3H2(g) 2NH3(g)
2NH3(g)
(1)若反应进行到某时刻t时,nt(N2)="13" mol,nt(NH3)="6" mol,计算a= 。
(2)反应达平衡时,混合气体的体积为716.8 L(标况下),其中NH3的含量(体积分数)为25%。计算原混合气体与平衡混合气体的总物质的量之比
(3)平衡混合气体中,n(N2)∶n(H2)∶n(NH3)=___________。
 2NH3(g)
2NH3(g)(1)若反应进行到某时刻t时,nt(N2)="13" mol,nt(NH3)="6" mol,计算a= 。
(2)反应达平衡时,混合气体的体积为716.8 L(标况下),其中NH3的含量(体积分数)为25%。计算原混合气体与平衡混合气体的总物质的量之比
(3)平衡混合气体中,n(N2)∶n(H2)∶n(NH3)=___________。

略

练习册系列答案
 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案
相关题目
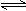 2C(g) △H<0,下列各图正确的是( )
2C(g) △H<0,下列各图正确的是( )
 HBr+HBrO,当加入AgNO3溶液后溶液颜色变浅
HBr+HBrO,当加入AgNO3溶液后溶液颜色变浅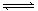 C(g)+D(g)达到平衡的标志是( )
C(g)+D(g)达到平衡的标志是( )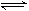 CaMg2Al2Si3O12
CaMg2Al2Si3O12 CH3OH(g)+H2O(g) △H=-49.0kJ/mol
CH3OH(g)+H2O(g) △H=-49.0kJ/mol

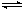 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)  ΔH1
ΔH1
 2C(g)+2D(g) △H=Q,2 min末达到平衡,生成0.8 mol D。
2C(g)+2D(g) △H=Q,2 min末达到平衡,生成0.8 mol D。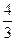 mol。若使平衡时
mol。若使平衡时 各物质的物质的量浓度与原平衡相同,则还应该加入B mol。
各物质的物质的量浓度与原平衡相同,则还应该加入B mol。