题目内容
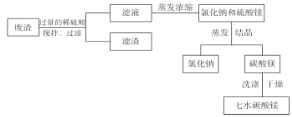
【题目】市售一次电池品种很多,碱性锌锰电池在日常生活中用量很大。回收废旧锌锰电池并进行重新处理,可以获得MnO2及其他副产品,其工艺流程如下:

已知:“锰粉”的主要成分有MnO2、Zn(OH)2、MnOOH、碳粉,还含有少量铁盐和亚铁盐。常温下,生成氢氧化物沉淀的pH如下表:
物质 | Fe(OH)3 | Fe(OH)2 | Zn(OH)2 | Mn(OH)2 / Mn(OH)3 |
开始沉淀pH | 2.7 | 7.6 | 5.7 | 8.3 |
完全沉淀pH(c≤1.0×10-5mol/L) | 3.7 | 9.6 | 8.0 | 8.8 |
(1)加入NaOH溶液调节pH=8.0,目的是___________________________________;计算常温下Zn(OH)2的溶度积常数Ksp[Zn(OH)2]=____________________。
(2)滤液1中加入H2O2的作用是________________________________________。
(3)写出滤液2中的Mn2+变成MnO2的离子方程式_______________________________。
(4)写出滤渣B与稀硫酸在pH=5时反应的化学方程式_____________________________。
(5)工艺中还可以将滤液4进行_____________、_____________、_____________、洗涤得到含结晶水的硫酸盐晶体。
(6)MnO2常用来制取KMnO4。在一定条件下将MnO2氧化为K2MnO4,然后用铁作阴极、铂作阳极电解K2MnO4溶液得到KMnO4。电解K2MnO4溶液阳极电极反应式为____________________。
【答案】(1)使Fe3+ 、Zn2+ 完全沉淀而除去 1.0×10-17(2)Fe2+全部氧化为Fe3+
(3) Mn2++H2O2+2OH-=MnO2↓+2H2O (4) Zn(OH)2+H2SO4=ZnSO4+2H2O
(5) 蒸发浓缩、冷却结晶、过滤 (6) 2MnO42--2e-=2MnO4-
【解析】
试题分析:锰粉与盐酸反应后溶液中的金属离子有:Fe3+ 、Zn2+、 Mn2+ 、Fe2+,加入H2O2会将Fe2+氧化为 Fe3+,用NaOH溶液调节pH=8.0,根据金属离子沉淀的pH,可知Fe3+ 、Zn2+完全沉淀,Mn2+没有沉淀,所以滤液2中主要的金属离子是Mn2+,滤渣B是Zn(OH)2, Fe(OH)3,加入硫酸,调节pH为5,Zn(OH)2会溶解,Fe(OH)3没有溶解,故滤液4是ZnSO4溶液,滤渣C是Fe(OH)3。
(1)加入NaOH溶液调节pH=8.0,目的是使Fe3+ 、Zn2+ 完全沉淀而除去;Zn2+完全沉淀时pH为8.0,则c(OH-)=10-6mol/L,c(Zn2+)=1.0×10-5mol/L,故Ksp[Zn(OH)2]=c(Zn2+)×c2(OH-)=1.0×10-5×10-12=1.0×10-17。
(2)滤液1中含有亚铁离子,需要转化为铁离子沉淀除去,则加入H2O2的作用是Fe2+全部氧化为Fe3+。
(3)滤液2中Mn的化合价升高,那么H2O2作氧化剂,Mn2+做还原剂,发生氧化还原反应,则Mn2+变成MnO2的离子方程式为Mn2++H2O2+2OH-=MnO2↓+2H2O。
(4)根据分析滤渣B与稀硫酸在pH=5时Zn(OH)2会溶解,Fe(OH)3没有溶解,反应的化学方程式为:Zn(OH)2+H2SO4=ZnSO4+2H2O。
(5)从溶液中得到晶体要经过:蒸发浓缩、冷却结晶、过滤、洗涤得到含结晶水的硫酸盐晶体。
(6)电解K2MnO4溶液得到KMnO4。MnO42-在阳极放电生成MnO4—,阴极是H+放电生成H2,因此电解K2MnO4溶液阳极电极反应式为2MnO42--2e-=2MnO4-。

 阅读快车系列答案
阅读快车系列答案【题目】化学与生活息息相关。下表中有关物质用途与原因解释不正确的是( )
选项 | 现象或事实 | 解释 |
A. | 肉制品中添加适量的亚硝酸钠 | 亚硝酸钠有防腐的作用 |
B. | 甘油护肤保湿 | 甘油沸点高且能与水分子之间形成氢键 |
C. | 硅是信息高速公路的骨架 | 硅具有良好的传递光信号的性能 |
D. | Al(OH)3用作塑料的阻燃剂 | Al(OH)3受热分解吸收大量的热,且能起阻隔作用 |
A.AB.BC.CD.D