题目内容
【题目】已知三氯化铁的熔点为306℃,沸点为315℃,易溶于水并且有强烈的吸水性,能吸收空气里的水分而潮解。某学习小组的同学对氯气与铁的反应及产物做了如下探究实验:
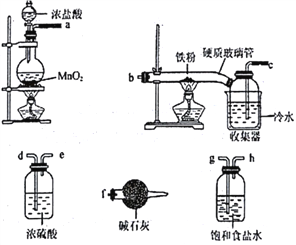
(1)装碱石灰的仪器是____________(填仪器名称),碱石灰的作用______________________。
(2)装置的连接顺序为_________________________。
(3)反应一段时间后熄灭酒精灯,冷却后将硬质玻璃管及收集器中的物质一并快速转移
至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验:
![]()
①固体混合物的成分是_____________________。(填化学式)
②淡黄色溶液中加入试剂X生成淡红色溶液的离子反应方程式为_______________________________。
(4)已知红色褪去的同时有气体生成,经检验为O2。该小组内的同学们对红色褪去的原因提出了三种假设。
假设I:H2O2还原Fe3+,使其转变为Fe2+;
假设Ⅱ:H2O2分解生成O2,O2氧化试剂X;
假设Ⅲ:__________________________________。(如果表达中遇到试剂X,请写出其化学式)。
并对假设进行了以下实验研究:
①取褪色后溶液三份,第一份滴加FeCl3溶液无明显变化;第二份滴加试剂X,溶液出现红色;第三份滴加稀盐酸和BaCl2溶液,产生白色沉淀。
②另取同浓度的 FeCl3溶液滴加2滴试剂X,溶液变红,再通入O2,无明显变化。 实验①说明假设__________不正确; 实验②的目的是_______________;由实验①②得出假设________是正确的。
【答案】 干燥管 吸收未反应完的氯气防止污染环境,防止空气中的水蒸汽进入收集器中使氯化铁潮解 aghdebcf Fe FeCl3 Fe3++3SCN-![]() Fe(SCN)3 H2O2氧化KSCN Ⅰ 证明假设Ⅱ不成立 Ⅲ
Fe(SCN)3 H2O2氧化KSCN Ⅰ 证明假设Ⅱ不成立 Ⅲ
【解析】本题考查实验方案设计与评价,(1)装碱石灰的仪器为干燥管或球形干燥管,根据实验目的,首先制备氯气,制备的氯气中含有HCl和水蒸气,HCl和水蒸气影响后续实验,因此必须除去,即a→g→h→d→e,得到纯净的氯气,与铁粉反应,即e→b→c,因为氯气有毒,且FeCl3易潮解,因此c→f,因此碱石灰的作用是除去未反应的氯气,以及防止空气中水蒸气进入收集器;(2)根据(1)的分析,连接顺序是aghdebcf;(3)①固体混合物中加入过量的盐酸,出现淡黄色溶液,加入试剂X,出现淡红色溶液,试剂X为KSCN,说明固体混合物中含有FeCl3,加入过量H2O2,出现深红色溶液,推出溶液中Fe3+浓度增大,即固体混合物中含有Fe,因此固体混合物成分是Fe和FeCl3;②试剂X为KSCN,加入KSCN溶液后,生成淡红色溶液,说明溶液中有Fe3+,发生的离子反应为Fe3++3SCN-![]() Fe(SCN)3 ;(4)过氧化氢具有强氧化性,可能氧化了KSCN;第一份溶液滴加FeCl3溶液,溶液不变红,说明溶液中无KSCN,第二份滴加试剂KSCN,溶液出现红色,说明溶液中含有Fe3+,因此说明假设I不正确;实验②的目的是证明假设II不成立;由上述分析,说明实验III正确。
Fe(SCN)3 ;(4)过氧化氢具有强氧化性,可能氧化了KSCN;第一份溶液滴加FeCl3溶液,溶液不变红,说明溶液中无KSCN,第二份滴加试剂KSCN,溶液出现红色,说明溶液中含有Fe3+,因此说明假设I不正确;实验②的目的是证明假设II不成立;由上述分析,说明实验III正确。