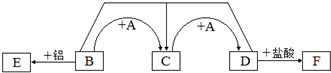
题目内容
16.用相应的化学用语表达:(1)已知:在一定条件下,当有64g SO2气体氧化为SO3气体时放出99kJ的热量,请写出SO2氧化为SO3的热化学方程式SO2(g)+$\frac{1}{2}$O2(g)=SO3(g)△H=-99kJ•mol-1.
(2)氯化铁水解的离子方程式Fe3++3H2O?Fe(OH)3+3H+.
(3)用浓度表示碳酸钠溶液中电荷守恒的式子c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-).
(4)用浓度表示碳酸氢钠溶液中物料守恒的式子c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3).
(5)将等体积等浓度的AgNO3溶液和NaCl溶液混合得到浊液W,浊液W中存在的沉淀溶解平衡的方程式为AgCl(g)?Ag+(aq)+Cl-(aq).
分析 (1)根据64g SO2气体即1mol,氧化为SO3气体时放出99kJ的热量,结合热化学方程式的书写规则分析;
(2)三价铁离子水解生成氢氧化铁和氢离子;
(3)溶液中阳离子所带电荷等于阴离子所带电荷,溶液呈电中性;
(4)碳酸氢钠溶液中Na的总浓度等于C的总浓度;
(5)AgNO3溶液和NaCl溶液混合得到AgCl白色沉淀,Ag存在的沉淀溶解平衡.
解答 解:(1)因64g 即1molSO2气体氧化为SO3气体时放出99kJ的热量,则其热化学方程式为SO2(g)+$\frac{1}{2}$O2(g)=SO3(g)△H=-99kJ•mol-1,
故答案为:SO2(g)+$\frac{1}{2}$O2(g)=SO3(g)△H=-99kJ•mol-1;
(2)FeCl3为强酸弱碱盐,Fe3+离子水解使溶液呈酸性,水解方程式为Fe3++3H2O?Fe(OH)3+3H+;
故答案为:Fe3++3H2O?Fe(OH)3+3H+;
(3)Na2CO3的溶液中存在两步水解,以第一步水解为主,溶液中存在的电荷守恒关系是c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),
故答案为:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-);
(4)碳酸氢钠溶液中Na的总浓度等于C的总浓度,则c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3);
故答案为:c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3);
(5)AgNO3溶液和NaCl溶液混合得到AgCl白色沉淀,Ag存在的沉淀溶解平衡为AgCl(g)?Ag+(aq)+Cl-(aq);
故答案为:AgCl(g)?Ag+(aq)+Cl-(aq).
点评 本题考查了热化学方程式的书写、盐类水解的应用、沉淀溶解平衡,侧重于化学知识的综合运用的考查,注意把握盐类水解的原理,理解电荷守恒和物料守恒的运用,题目难度不大.

 阅读快车系列答案
阅读快车系列答案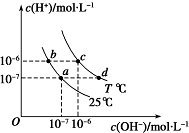
| A. | 两条曲线上任意点均有c(H+)×c (OH-)=Kw | |
| B. | T<25 | |
| C. | b点和c点pH均为6,溶液呈酸性 | |
| D. | 只采用升温的方式,可由a点变成d点 |
| A. | 碳酸钠 | B. | 二氧化硫 | C. | 双氧水 | D. | 次氯酸钠 |
| A. | 氢氧化铝受热分解 | |
| B. | 氧化铜与硝酸反应 | |
| C. | 实验室中用高锰酸钾加热分解制取 氧气 | |
| D. | 实验室中用氯化铵固体与氢氧化钙固体制取氨气 |
| A. | 苯酚遇三氯化铁溶液变血红色 | B. | 淀粉溶液遇碘酸钾变蓝色 | ||
| C. | 植物油遇溴水变黄色 | D. | 氧化铜遇热的乙醇变红色 |
| A. | 常温常压下,14.2克 Na2SO4含有的Na+离子数为0.2NA | |
| B. | 标准状况下,22.4LH2O含有的分子数为 NA | |
| C. | 通常状况下,NA个N2分子占有的体积为22.4L | |
| D. | 物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl- 个数为NA |