题目内容
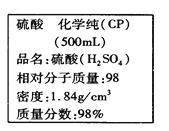
【题目】在实验室里,用足量的浓盐酸与一定量的MnO2反应,来制取氯气。MnO2 + 4HCl(浓)![]() MnCl2 + Cl2↑ + 2H2O,若生成2.24L标准状况时的氯气,请计算(写出必要的计算过程):
MnCl2 + Cl2↑ + 2H2O,若生成2.24L标准状况时的氯气,请计算(写出必要的计算过程):
(1)理论上需要多少克MnO2参加反应?_____________
(2)参加反应的HCl的物质的量为多少?_____________
(3)被氧化的HCl的物质的量为多少?____________
【答案】8.7g 0.4mol 0.2mol
【解析】
反应中Mn元素化合价降低,化合价由+4价降低到+2价,Cl元素化合价升高,由-1价升高到0价,化合价升高值=化合价降低值=转移电子数;n(Cl2)=![]() =0.1mol,参加反应的盐酸是被氧化盐酸的物质的量的2倍,结合反应的化学方程式计算。
=0.1mol,参加反应的盐酸是被氧化盐酸的物质的量的2倍,结合反应的化学方程式计算。
(1)n(Cl2)=2.24L÷22.4L·mol-1=0.1mol,
①MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
87g 1mol
m 0.1mol
m=8.7g,
答:理论上需要8.7gMnO2参加反应;
(2)①MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
4mol 1mol
0.4mol 0.1mol
参加反应的HCl的物质的量为0.4mol;
(3)MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O 被氧化HCl
MnCl2+Cl2↑+2H2O 被氧化HCl
1mol 2mol
0.1mol 0.2mol,
被氧化的HCl的物质的量为0.2mol。

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目