题目内容
2. 如图所示的电化学装置,可用于净化处理厕所排放废水中的尿素( H2 NCON H2),同时产生电能.下列有关说法不正确的是( )
如图所示的电化学装置,可用于净化处理厕所排放废水中的尿素( H2 NCON H2),同时产生电能.下列有关说法不正确的是( )| A. | 右侧的多孔碳电极是原电池的负极 | |
| B. | 电解质溶液中H十向左侧移动 | |
| C. | 正极上发生还原反应:H2NCONH2+H2O-6e-═c-CO2+N2+6N+ | |
| D. | 电极上消耗标准状况下33.6LO2,电路中转移6 mol电子 |
分析 A、在该原电池中,通入氧气的电极是正极,通入尿素( H2 NCON H2)的电极是负极;
B、原电池中,电解质里的阳离子移向正极;
C、原电池的正极上发生得电子的还原反应;
D、根据正极上氧气得电子的还原反应进行计算即可.
解答 解:A、在该原电池中,通入氧气的电极是正极,通入尿素( H2 NCON H2)的电极是负极,即左侧多孔碳电极是原电池的正极,右侧为负极,故A正确;
B、电解质溶液中H+向电池正极移动,即向左侧移动,故B正确;
C、H2NCONH2是在负极上发生氧化反应:H2NCONH2+H2O-6e-═CO2+N2+6H+,故C错误;
D、根据正极上的反应O2+4H++4e-=2H2O,当电极上消耗标准状况下33.6L即1.5molO2时,电子转移为6mol,故D正确.
故选C.
点评 本题考查学生原电池工作原理以及应用,注意电极反应式的书写以及计算是关键,难度中等.

练习册系列答案
相关题目
17.用NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 60 g SiO2晶体中含有Si-O键数目为2NA | |
| B. | 常温常压下,1.6 9 O2和O3的混合气体所含电子数为0.8NA | |
| C. | 1 mol/L AICl3溶液中,所含Al3+数目小于NA | |
| D. | 密闭容器中2 mol NO与l mol 02充分反应,产物的分子数为2NA |
7.已知酸性高锰酸钾溶液可以将FeSO4 氧化,反应的化学方程式为 2KMnO4+10FeSO4+8H2SO4═K2SO4+X+5Fe2(SO4)3+8H2O,现将一定量的硫酸酸化的高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中铁离子的物质的量随加入的KI的物质的量的变化关系如图所示,则下列有关说法不正确的是( )

| A. | 方程式中的X为2MnSO4 | |
| B. | 氧化性:KMnO4>Fe3+>I2 | |
| C. | 根据OC段的数据可知开始加入的高锰酸钾的物质的量为0.30 mol | |
| D. | AB段是高锰酸钾和碘化钾溶液反应,BC段的反应为2Fe3++2I-═2Fe2++I2 |
7.利用下列实验装置图进行的相应实验,能达到实验目的是( )
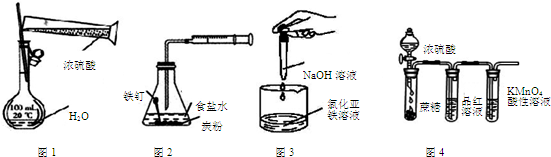

| A. | 用图1装置配制一定物质的量浓度的稀硫酸 | |
| B. | 用图2装置可探究铁的吸氧腐蚀 | |
| C. | 用图3装置可制取氢氧化亚铁 | |
| D. | 用图4装置可说明浓硫酸具有脱水性、强氧化性,SO2具有漂白性、氧化性 |

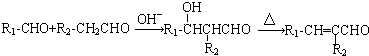
 .反应①~⑤中属于取代反应的有③④⑤(填序号).
.反应①~⑤中属于取代反应的有③④⑤(填序号). .
. .
. ;
; .
.