��Ŀ����
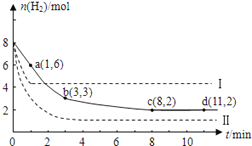
����Ŀ����ҵ����һ����CO2�������״�ȼ�ϵķ�����CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g); ��H=-49.0kJ/mol��ij�¶��£���6molCO2��8molH2����2L���ܱ������У����H2�����ʵ�����ʱ��仯��ͼʵ����ʾ��ʵ�ߣ���ͼ������a��1,6����ʾ����1minʱH2�����ʵ�����6mol��
CH3OH(g)+H2O(g); ��H=-49.0kJ/mol��ij�¶��£���6molCO2��8molH2����2L���ܱ������У����H2�����ʵ�����ʱ��仯��ͼʵ����ʾ��ʵ�ߣ���ͼ������a��1,6����ʾ����1minʱH2�����ʵ�����6mol��
��1����һ������H2��ƽ����Ӧ������________��ʽ��������¶��µĻ�ѧƽ�ⳣ��K=______
��2������ʱ���ƽ����Ӧ����������_______
A.0-1min B.1-3min C.3-8min D.8-11min
��3�����ı�ijһʵ�������ٽ�������ʵ����H2�����ʵ�����ʱ��仯��ͼ��������ʾ������I��Ӧ��ʵ�������ı���__________�����ߢ��Ӧ��ʵ�������ı����_____________��
��4������d��ʱ����ϵ�ڳ���2molCO2��2molH2O����ʱV��_____V�������ڣ�С�ڣ����ڣ�
��5����֪��
��CO(g)+1/2O2(g)=CO2(g); ��H1=-283.0kJ/mol
��H2(g)+1/2O2(g)=H2O(g); ��H2=-241.8kJ/mol
��CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g); ��H3=-192.2kJ/mol
�ڹ�ҵ�ϳ���CO��H2�ϳɼ״����÷�Ӧ���ȷ���ʽΪ_____________
��6����ͼ�Ǽ״�ȼ�ϵ��ԭ��ʾ��ͼ���ش��������⣺��ظ����ĵ缫��Ӧ�ǣ�__________��

���𰸡� 1mol/(L��min) K=(1��1)/(2��1)=0.5 A ���� ����ѹǿ������CO2Ũ�� С�� CO(g)+2H2(g) ![]() CH3OH(g) ��H=-574.4kJ/mol CH3OH+8OH--6e-=CO32-+6H2O
CH3OH(g) ��H=-574.4kJ/mol CH3OH+8OH--6e-=CO32-+6H2O
��������(1)��һ������H2��ƽ����Ӧ������ =1mol/(L��min) �� CO2(g)+3H2(g)
=1mol/(L��min) �� CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)��ʼ���ʵ���/mol6 8 00���ʵ����仯/mol262 2ƽ�����ʵ���/mol 4 2 22
CH3OH(g)+H2O(g)��ʼ���ʵ���/mol6 8 00���ʵ����仯/mol262 2ƽ�����ʵ���/mol 4 2 22
K=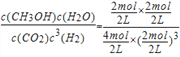 =0.5L2mol-2��(2)�ֱ���㲻ͬʱ���ڵķ�Ӧ���ʣ�0��1min�ڣ�v(H2)=1mol/(L��min) ��1��3min�ڣ�v(H2)=
=0.5L2mol-2��(2)�ֱ���㲻ͬʱ���ڵķ�Ӧ���ʣ�0��1min�ڣ�v(H2)=1mol/(L��min) ��1��3min�ڣ�v(H2)= ![]() =0.75mol/(Lmin)��3��8min�ڣ�v(H2)=
=0.75mol/(Lmin)��3��8min�ڣ�v(H2)= ![]() =0.1mol/(Lmin)��8min��ﵽ��ѧƽ��״̬�����淴Ӧ������ȣ��ۺ�����Ϊ�㣻����0��1min�ڷ�Ӧ�������8��11min��Ӧ������С���ʴ�ΪA��(3)����I��Ӧ��������ת�������������ʵ����٣�Ӧ�������¶ȣ���÷�Ӧ���ȣ������¶�ƽ�������ƶ���������������ת����������I�������¶ȣ���������Ӧ��������ת�������������ʵ����࣬������ѹǿƽ�������ƶ�����Ӧ������ѹǿ�����������̼Ũ��Ҳ��ʹƽ��������У�
=0.1mol/(Lmin)��8min��ﵽ��ѧƽ��״̬�����淴Ӧ������ȣ��ۺ�����Ϊ�㣻����0��1min�ڷ�Ӧ�������8��11min��Ӧ������С���ʴ�ΪA��(3)����I��Ӧ��������ת�������������ʵ����٣�Ӧ�������¶ȣ���÷�Ӧ���ȣ������¶�ƽ�������ƶ���������������ת����������I�������¶ȣ���������Ӧ��������ת�������������ʵ����࣬������ѹǿƽ�������ƶ�����Ӧ������ѹǿ�����������̼Ũ��Ҳ��ʹƽ��������У�
(4) ����d��ʱ����ϵ�ڳ���2molCO2��2molH2O����ʱQc=![]() =
= =
=![]() L2mol-2��K����ʱƽ�������ƶ�����V��С��V����
L2mol-2��K����ʱƽ�������ƶ�����V��С��V����
(5)��֪����CO(g)+1/2O2(g)=CO2(g); ��H1=-283.0kJ/mol����H2(g)+1/2O2(g)=H2O(g); ��H2=-241.8kJ/mol����CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g); ��H3=-192.2kJ/mol�����ݸ�˹���ɿ�֪��+����2-���ɵ� CO(g)+2H2(g) ![]() CH3OH(g)���� ��H=(-283.0kJ/mol)+(-241.8kJ/mol)��2-(-192.2kJ/mol)=-574.4kJ/mol��CO��H2�ϳɼ״����ȷ���ʽΪ CO(g)+2H2(g)
CH3OH(g)���� ��H=(-283.0kJ/mol)+(-241.8kJ/mol)��2-(-192.2kJ/mol)=-574.4kJ/mol��CO��H2�ϳɼ״����ȷ���ʽΪ CO(g)+2H2(g) ![]() CH3OH(g) ��H=-574.4kJ/mol ��
CH3OH(g) ��H=-574.4kJ/mol ��
(6)�״�ȼ�ϵ���У�ͨ��������b��Ϊԭ��ص������������õ��ӵĻ�ԭ��Ӧ���ڼ��Ի����£��缫��ӦʽΪ��2H2O+4e-+O2�T4OH-��ͨ��״���a��Ϊԭ��صĸ���������ʧ���ӵ�������Ӧ���缫��ӦʽΪ��CH3OH+8OH--6e-�TCO32-+6H2O��

����Ŀ����1�� ��ú��Ϊȼ�Ͽ�ͨ����������;����
;��I��ֱ��ȼ��C(s)+O2(g)�TCO2(g)������Q1kJ��
;��II�����Ƴ�ˮú����C(s)+H2O(g)�TCO(g)+H2(g)������Q2kJ��
��ȼ��ˮú����2CO(g)+O2(g)�T2CO2(g)
2H2(g)+O2(g)�T2H2O(g)��������Q3kJ��
�Իش��������⣺
���ж�����;���ų�������С��;��I ______������ڡ��������ڡ���С�ڡ���;��II
��Q 1��Q 2 ��Q 3 ����ѧ��ϵʽ��________________________��
����֪1 g������ȫȼ������Һ̬ˮʱ�ų�����143 kJ��18 gˮ�������Һ̬ˮ�ų�44 kJ��������
��������������±��������x��ֵΪ_____________��
O===O | H��H | H��O(g) | |
1 mol��ѧ������ʱ��Ҫ���յ�����/kJ | 496 | 436 | x |
�ܼ���úͨ��;������Ϊȼ�ϵ����壺______________________________

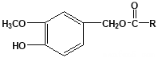
��2����ѧ��Ӧ����Ϊ�ɼ����Ѻ��¼��γɵĹ��̡���ͼΪ���ף�P4����P4O6���ӵķ��ӽṹʾ��ͼ����������������±���ʾ����ӦP4 +3O2 = P4O6�������仯Ϊ��__________________��
O===O | P��P | P��O | |
1 mol��ѧ������ʱ��Ҫ���յ�����/kJ | 496 | 198 | 360 |
��3�����б仯�����ڷ��ȷ�Ӧ����______
A��Ba(OH)2��8H2O������NH4Cl����ķ�Ӧ
B��þ���������̼��Ӧ
C���ɱ�����Ϊ����
D��̼��Ƹ��¶���
����Ŀ����ƽ�а������±����л���A��B���й���Ϣ��
A | B |
����ʹ������Ȼ�̼��Һ��ɫ �ڱ���ģ��Ϊ�� ������ˮ��һ�������·�Ӧ���ɴ� | ����C��H����Ԫ����� �����ģ��Ϊ�� |
���ݱ�����Ϣ�ش��������⣺
��1��д��A�ĵ���ʽ_____________________��
��2��д����һ�������£�A���ɸ߷��ӻ�����Ļ�ѧ��Ӧ����ʽ________________________________��
��3��A�����������ӳɷ�Ӧ�����ɷ���C��C�ڷ�����ɺͽṹ�����Ƶ��л�����һ���ࣨ�׳ơ�ͬϵ��������Ǿ�����ͨʽCnH2n��2����n��_____ ʱ�������л��↑ʼ����ͬ���칹�塣
��4��B���е�������_____________________������ţ���
����ɫ��ζҺ�� ���ж� �۲�����ˮ ���ܶȱ�ˮ��
��������KMnO4��Һ����ˮ��Ӧʹ֮��ɫ ���κ������²���������Ӧ
��5��д����Ũ���������£�B��Ũ���ᷴӦ�Ļ�ѧ����ʽ��_____________________________��